
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | MgCl2 |
分析 (1)硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,硫酸与氧化铁反应生成硫酸铁和水,硫酸与铁反应生成硫酸亚铁和氢气,依此进行判断;氢氧化钠与氯化钡、氧化铁、铁都不反应;
(2)依据化学方程式为KCN+H2O2+H2O=KHCO3+A↑,结合原子个数守恒判断;依据化学方程式为:KCN+H2O2+H2O=KHCO3+NH3↑,C由+2价被氧化为KHCO3中的+4,H2O2中的氧元素化合价降低,元素化合价降低的反应物为氧化剂,据此判断;
(3)根据所给电解质的组成微粒分析电解后的离子,然后依据电离方程式的书写规则进行书写,强电解质写“=”、弱电解质写“?”,且要遵循原子守恒、电荷守恒,硫酸铁、氯酸钾、硫酸氢钠三种物质都为强电解质;
(4)酸是指电离产生的阳离子都是氢离子的化合物,酸式盐是多元酸和碱发生部分中和反应生成的盐,电解质是在水溶液中或熔融状态下能导电的化合物,能电离出氢离子,硫酸氢钠在水中完全电离产生钠离子、氢离子和硫酸根离子,据此解答;
(5)向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体.
解答 解:(1)硫酸与氯化钡反应生成硫酸钡沉淀和盐酸,硫酸与氧化铁反应生成硫酸铁和水,硫酸与锌反应生成硫酸锌和氢气,故第Ⅲ组中的H2SO4能与第Ⅰ组中的所有物质反应,氢氧化钠与氯化钡、氧化铁、锌都不反应;
故答案为:Ⅰ;H2SO4;NaOH;
(2)①依据化学方程式为:KCN+H2O2+H2O=KHCO3+A↑,由原子个数守恒可知:A中有1个氮原子和3个氢原子,为NH3,
故答案为:NH3;
②KCN+H2O2+H2O=KHCO3+NH3↑,反应中KCN中C的化合价由+2升高到+4,则被氧化的元素为C,
故答案为:C;
③双氧水中的O有-1价降为-2价所以双氧水为氧化剂,
故答案为:H2O2;
(3)硫酸铁是强电解质,能完全电离,电离方程式为Fe2(SO4)3=2Fe3++3SO42-,氯酸钾为强电解质,完全电离生成钾离子与氯酸根离子,电离方程式为:KClO3=K++ClO3-,硫酸氢钠为强电解质,在熔融状态下完全电离生成钠离子和硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;KClO3=K++ClO3-;NaHSO4=Na++HSO4-;
(4)A.在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,NaHSO4在水溶液中电离出H+、Na+、SO42-,含有阳离子钠离子,所以NaHSO4不属于酸,故A错误;
B.NaHSO4含有酸根离子、金属阳离子和氢离子,属于酸式盐,故B正确;
C.NaHSO4溶液是混合物,电解质必须是化合物,故C错误;
D.NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,电离方程式为:NaHSO4═Na++H++SO42-,氢离子与锌反应,所以NaHSO4溶液能与Zn反应生成氢气,故D正确;
故答案为:BD;
(5)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热.
点评 本题考查了物质的分类、氧化还原、电解质、胶体的制备等知识,较为综合,比较基础,注意硫酸氢钠在溶液与熔融状态下的电离的异同,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
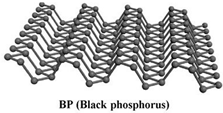 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于高分子化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
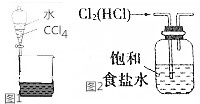 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
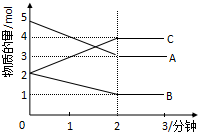 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
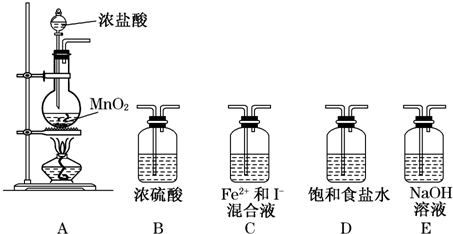
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com