
| Zn | ZnO | ZnS | CuS | BaSO4 | H2S | |
| 熔点/℃ | 419.5 | 1975(同时分解) | - | - | - | - |
| 沸点/℃ | 907 | - | - | - | - | - |
| Ksp(常温) | - | - | 2.5×10-21 | 6.4×10-35 | 1.1×10-10 | K1=1.1×10-7 K2=1.3×10-13 |
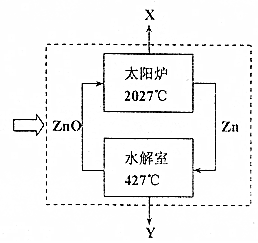
分析 (1)水解室中在427℃条件下,锌和水蒸气反应生成氧化锌和氢气,Y为氢气,氧化锌在太阳炉中在2027℃条件下分解生成锌和氧气,X为氧气,锌循环利用.
①a.装置A中有太阳能、化学能、热能相互转化形式;
b.氧气和锌易反应,太阳炉中须首要解决的问题是产物的及时分离和冷却;
c.该法水解室产生H2,太阳炉产生O2,分步产生,不须考虑隔离问题;
②利用锌和太阳能分解水循坏制氢,该反应的本质为利用太阳能分解水分解生成氢气、氧气,需补充消耗的物质,在反应中未消耗的物质为可循环的物质;
③燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据H2的燃烧热以及1molZnO完全分解生成液态锌和氧气时吸收350.5kJ热量,书写热化学方程式,结合盖斯定律进行解答;
(2)①根据硫化铜、硫化锌的Ksp计算;
②a.常温下,硫化铜不溶于水和硫酸;
b.常温下,ZnS为白色,CuS为黑色;
c.常温下,向饱和CuSO4溶液中通入H2S,生成黑色CuS;
d.常温下,0.1molBaS(易溶)与100mL1mol/ZnSO4恰好完全反应;
③以铝和石墨分别为两电极电解ZnSO4溶液,制取锌,阳极为石墨,阴极为铝,阳极OH-发生氧化反应,阴极锌得电子生成锌单质.
解答 解:(1)①a.装置A水解室中在427℃条件下,锌和水蒸气反应生成氧化锌和氢气,为热能转化为化学能,氧化锌在太阳炉中在2027℃条件下分解生成锌和氧气,为太阳能转化为热能,故a错误;
b.锌为活泼金属,氧化锌在太阳炉中在2027℃条件下分解生成锌和氧气,太阳炉中须首要解决的问题是产物的及时分离和冷却,故b正确;
c.电解水同时得到氢气和氧气,该法水解室产生H2,太阳炉产生O2,相比该法的优点:H2与O2分步产生,不须考虑隔离问题,故c正确;
故答案为:a;
②水解室中在427℃条件下,锌和水蒸气反应生成氧化锌和氢气,Y为氢气,氧化锌在太阳炉中在2027℃条件下分解生成锌和氧气,X为氧气,需不断消耗太阳能和水,所以生产过程中不断向装置A中输入太阳光和水,整个生产过程中锌未消耗,可循环利用,
故答案为:水;氧气、氢气;锌;
③H2的燃烧热为285.5KJ/mol,根据燃烧热可知热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.5KJ/mol①,1molZnO完全分解生成液态锌和氧气时吸收350.5kJ热量,热化学方程式为:ZnO(S)=Zn(l)+$\frac{1}{2}$O2(g)△H=+350.5kJ/mol②,1mol H2O(g)完全凝结为液态,放出44.0kJ热量,H2O(g)=H2O(l),△H=-44.0kJ/mol③,
水解室中在427℃条件下,锌和水蒸气反应生成氧化锌和氢气,根据盖斯定律将,Zn(S)+H2O(g)=ZnO (S)+H2(g)△H=-109KJ/mol,
故答案为:Zn(S)+H2O(g)=ZnO (S)+H2(g)△H=-109KJ/mol;
(2)①ZnS+Cu2+?Zn2++CuS在常温下的平衡常数K=$\frac{{K}_{SP}(ZnS)}{{K}_{SP}(CuS)}$=$\frac{2.5×1{0}^{-21}}{6.4×1{0}^{-35}}$≈3.91×1013,
故答案为:3.91×1013;
②a.常温下,反应CuSO4+H2S=CuS↓+H2SO4能进行,CuS不能溶于稀硫酸,故a正确;
b.根据硫化铜、硫化锌的Ksp可知,常温下,ZnS与0.2mol/LCuSO4溶液作用,硫化锌转化为硫化铜,所以固体由白变黑,故b正确;
c.常温下,向饱和CuSO4溶液中通入H2S,发生反应CuSO4+H2S=CuS↓+H2SO4,有黑色CuS沉淀生成,故c错误;
d.常温下,0.1molBaS(易溶)与100mL1mol/ZnSO4溶液,恰好发生:BaS+ZnSO4=ZnS↓+BaSO4↓,故d正确;
故答案为:c;
③以铝和石墨分别为两电极电解ZnSO4溶液,制取锌,金属锌便以99.95%的纯度沉积在铝电极上,所以阳极为石墨,阴极为铝,阳极OH-发生氧化反应,电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑.
点评 本题考查利用锌和太阳能分解水循坏制氢,侧重考查学生综合应用知识的能力,掌握沉淀溶解平衡计算、电解池等知识是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: | B. | CCl4分子的比例模型: | ||
| C. | 乙烯与丁二烯的最简式相同 | D. | 2-甲基丁醇的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气、酒精分别属于化石能源、可再生能源 | |
| B. | 金属在潮湿空气中生锈,主要是发生析氢腐蚀 | |
| C. | NaClO具有强氧化性,可作织物漂白剂 | |
| D. | 高纯硅广泛应用于太阳能电池和半导体材料的制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时,正极区的pH增大 | |
| B. | 放电时,负极的电极反应式为PbO4+4H++2e-═Pb2++2H2O | |
| C. | 充电时,铅电极与电源的正极相连 | |
| D. | 充电时,当阴极生成20.7g Pb时溶液中有0.2mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造普通玻璃的主要原料是纯碱、石灰石和石英 | |
| B. | 盛放烧碱溶液的试剂瓶不能用玻璃塞 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
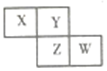 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示实验装置可用于制取乙炔.请填空:
如图所示实验装置可用于制取乙炔.请填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com