
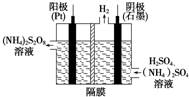
 (1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.
(1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.分析 (1)①在电解池的阳极上发生失电子的氧化反应,据此书写电极反应式;
②已知(NH4)2S2O8加热水解可得H2O2和(NH4)2SO4,利用原子守恒配平方程式;
(2)①在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,依据电荷守恒书写电极反应;
②依据过氧化氢不稳定分解生成水和氧气;
(3)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(4)电解盐酸的电解池中,阳极是Cl-失电子发生氧化反应的过程.
解答 解:(1)①在电解池的阳极上SO42-发生失电子的氧化反应,电极反应式为:SO42--2e-═S2O82-;
故答案为:SO42--2e-═S2O82-;
②已知(NH4)2S2O8加热和水发生水解反应可得H2O2和(NH4)2SO4,根据原子守恒可得:(NH4)2S2O8+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2O2+(NH4)2SO4+H2SO4;
故答案为:(NH4)2S2O8+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2O2+(NH4)2SO4+H2SO4;
(2)①在碱性条件下电解水,氧气在特制的阴极上反应可以得到HO2-离子,电解过程中氧气参与的阴极反应方程式为:O2+H2O+2e-=HO2-+OH-,
故答案为:O2+H2O+2e-=HO2-+OH-;
②H2O2与Ca(OH)2反应时,若不加稳定剂,需控制温度0~5℃,是因为过氧化氢受热易分解,故答案为:过氧化氢受热易分解;
故答案为:过氧化氢受热易分解;
(3)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(4)电解盐酸的电解池中,阳极是Cl-失电子发生氧化反应的过程,即电极反应式为:HCl+4H2O-8e-=HClO4+8H+,故答案为:HCl+4H2O-8e-=HClO4+8H+.
点评 本题考查了电解原理的分析和应用知识,注意知识的迁移应用是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
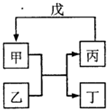 甲乙丙丁戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足右图转化关系的是( )
甲乙丙丁戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足右图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| A | NH3 | Cl2 | N2 | H2 |
| B | C | SiO2 | CO | CuO |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
| D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子是由原子核和核外电子构成的 | |
| B. | 保持水的化学性质的粒子是水分子 | |
| C. | 分子的质量总比原子的质量大 | |
| D. | 在化学反应中分子可分而原子不可分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸、空气、小苏打、乙醇 | B. | 生石灰、漂白粉、铁、二氧化硫 | ||
| C. | 明矾、盐酸、碳酸钙、氯气 | D. | 冰水混合物、氨水、纯碱、干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol/L的盐酸,产生CO2的体积与所加稀盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol/L的盐酸,产生CO2的体积与所加稀盐酸体积之间关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加Ba(OH)2溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加AgNO3溶液生成白色沉淀 | 原溶液中有Cl- |
| C | 滴加过量浓NaOH溶液并加热,将湿润红色石蕊试纸置于试管口,试纸变蓝色 | 原溶液中有NH4+ |
| D | 滴加氯水和CCl4,振荡、静置,上层溶液显紫红色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com