
分析 X、Y、Z、W、R为前四周期原予序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,X的一种核素用于鉴定文物年代,X为C,则Y为N,Z元素原子核外电子的运动状态共有8种,即核外有8个电子,Z为O,W为F,R元素与比它核电荷数大的另外两种元素位于第四周期同一族,即R为第ⅤⅢ族元素,为Fe由此分析解答.
解答 解:(1)X、Y、Z、W、R为前四周期原予序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,X的一种核素用于鉴定文物年代,X为C,则Y为N,Z元素原子核外电子的运动状态共有8种,即核外有8个电子,Z为O,W为F,R元素与比它核电荷数大的另外两种元素位于第四周期同一族,即R为第ⅤⅢ族元素,为Fe.
(1)X的一种核素用于鉴定文物年代,为质量数14的C原子,该原子是${\;}_{6}^{14}$C,故答案为:${\;}_{6}^{14}$C;
(2)同周期,从左向右第一电离能增大,但N原子最外层p电子半满为稳定结构,第一电离能由大到小的顺序为F、N、O、C,故答案为:F、N、O、C;
(3)F、O的电负性强,W的气态氢化物水溶液中存在氢键,氢键为F-H…O、O-H…F,故答案为:F-H…O、O-H…F;
(4)R为Fe,原子序数为26,价层电子排布式为3d64s2,位于d区,故答案为:3d64s2;d;
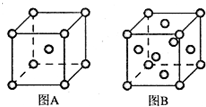
(5)A中原子占据体心和顶点,为体心立方结构,原子数为1+8×$\frac{1}{8}$=2,B中占据顶点和面心,原子数为6×$\frac{1}{2}$+8×$\frac{1}{8}$=5,体心立方配位数为8,面心立方配位数为12,所以A、B中R原子的配位数之比为2:3;A、B晶胞的棱长分别为a cm和b cm,体积分别为a3cm3、b3cm3,晶胞的密度等于晶胞中铁原子的质量与体积的比为$\frac{\frac{2m}{{a}^{3}}}{\frac{4m}{{b}^{3}}}$=$\frac{{b}^{3}}{2{a}^{3}}$,
故答案为:体心立方;2:3;$\frac{{b}^{3}}{2{a}^{3}}$.
点评 本题考查位置、结构、性质关系及应用,为高考常见题型,涉及元素周期表与元素周期律的综合应用、晶胞计算,注意利用均摊法计算原子个数,体心立方配位数为8,面心立方配位数为12,注意实际原子数与配位数的差别,侧重对学生分析能力的考查,注意把握原子半径的递变规律、化合价与位置关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
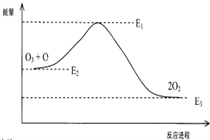
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | Cu | CuO | Cu(OH)2 |
| ② | CH3CH2OH | CH3CHO | CH2═CH2 |
| ③ | Na2CO3 | NaOH | NaHCO3 |
| ④ | CaCO3 | CaO | Ca(OH)2 |
| A. | ②③ | B. | ③④ | C. | ②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物为乙醇 | B. | 该化合物与乙醇互为同分异构体 | ||
| C. | 该化合物为乙醚 | D. | 该化合物与乙醚互为同分异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com