
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| C. | 1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 1L0.01 mol•L-1CKA1(SO4)2溶液中含有的阳离子数为0.02NA |
分析 A、求出64g碳化钙的物质的量,然后根据C22-中含3对共用电子对来分析
B、求出甲基(-CD3)的物质的量,然后根据甲基中含9个中子来分析;
C、1.5mol的MnO2粉末与足量浓盐酸反应后,锰元素由+4价变为+2价;
D、铝离子的水解导致阳离子个数增多.
解答 解:A、64g碳化钙的物质的量为1mol,而C22-中是碳碳三键,故含3对共用电子对,故1mol碳化钙中含3NA对共用电子对,故A正确;
B、1.8g甲基(-CD3)的物质的量为0.1mol,而甲基中含9个中子,故0.1mol甲基中含0.9NA个中子,故B错误;
C、1.5mol的MnO2粉末与足量浓盐酸能完全反应,且反应后锰元素由+4价变为+2价,故1.5mol二氧化锰反应后转移3mol电子即3NA个,故C错误;
D、铝离子的水解导致阳离子个数增多:Al3++3H2O?Al(OH)3+3H+,故溶液中阳离子个数多于0.02NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
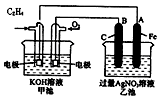 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)═c(OH-)-c(H+) | |
| C. | 25℃时,0.10mol•L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)═c(CO32-)+c (HCO3-)+c(H2CO3) | |
| D. | 向0.1mol•L-1CH3COONa溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)•c(O{H}^{-})}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
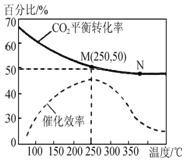 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )| A. | 平衡常数:KM>KN | |
| B. | 生成乙烯的速率一定有:v(M)<v(N) | |
| C. | 若投料比n(H2):n(CO2)=3:1,O 达到平衡时,M点乙烯的体积分数约为7.7% | |
| D. | 甲、乙、丙三个相同的恒容密闭容器中均充入0.3molH2和0.1molCO2,加入相同量的催化剂,反应温度T(甲)>T(乙)>T(丙),反应相同时间时,生成乙烯的产量一定为:甲>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 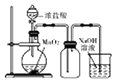 实验室制取Cl2 | B. | 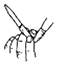 检查碱式滴定管是否漏液 | ||
| C. | 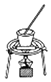 从食盐水中提取NaCl | D. | 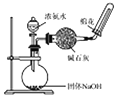 制备收集干燥的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 金属的硬度都比较大,不能用刀切 | |
| C. | “玉兔”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 煤经过气化和液化等物理变化可转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
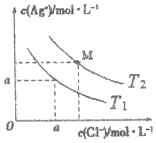 已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )
已知AgCl在水中的溶解是吸热过程.不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示.己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是( )| A. | T1>T2 | |
| B. | a=4.0×10-5 | |
| C. | M点溶液温度变为T1时,溶液中Cl-的浓度不变 | |
| D. | T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若B、D是空气的主要成分,则A可能用做制冷剂 | |
| B. | 若A、B、C的水溶液均显碱性,焰色反应均为黄色,则C可能用做胃酸中和剂 | |
| C. | 若D为生产生活中用量最大、用途最广泛的金属单质,则B可能为Fe( NO3)2 | |
| D. | 若B具有两性,则D可能为NaOH溶液或盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com