
下列物质性质的递变关系正确的有
①稳定性:HCl>H2S>PH3 ②离子半径:O2->F->Na+>Mg2+>Al3+
③碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 ④最高化合价:Cl>Si>Al>F
⑤沸点:HF>HCl>HBr>HI
A. ①②④⑤ B. ①②④ C. ①②⑤ D. ①④⑤
 互动英语系列答案
互动英语系列答案科目:高中化学 来源:2016-2017学年江苏省扬州市高二第二次(3月)学业水平模拟测试化学试卷(解析版) 题型:选择题
下列气体不能用排空气法收集的是
A. NH3 B. SO2 C. NO D. H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
X、Y、Z分别代表3种不同的短周期元素,X元素的原子最外层电子数为1,Y元素原子M层有6个电子,Z元素原子的L层电子数6,由这三种元素组成的化合物的化学式是
A. X3YZ4 B. X2YZ3 C. XYZ4 D. X4YZ4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:简答题
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
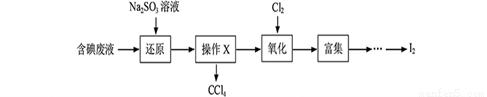
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为________________;该操作将I2还原为I-的目的是_____________________。
(2)操作X的名称为____________。
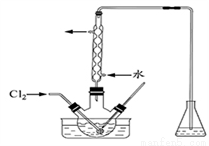
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如下图所示)。实验控制在较低温度下进行的原因是________________;锥形瓶里盛放的溶液为______________。
(4)已知:5SO32—+2IO3—+2H+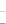 I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有IO3—的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;_____________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素原子的最外层电子数是次外层电子数的3倍,则下列叙述中肯定不正确的是
A. 原子半径:R>Q B. R和Q可形成离子化合物R2Q5
C. R和Q可形成共价化合物RQ D. R和Q可形成共价化合物RQ2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关氢化物的叙述中正确的是
A. 一个D216O分子中所含的中子数为8 B. H2S为共价化合物
C. 在卤化氢中HI最稳定 D. 酸性:HCl>HBr
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法:①离子化合物含离子键,也可能含极性键或非极性键;②含金属元素的化合物不一定是离子化合物;③由非金属元素组成的化合物一定是共价化合物;④熔融状态能导电的化合物是离子化合物。其中正确的有
A. ②③④ B. ①②④
C. ①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:简答题
研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJ•mol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJ•mol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJ•mol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
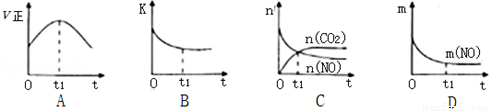
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A. Zn与稀H2SO4反应:2Zn+2H+=2Zn2++H2↑
B. 氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
C. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
D. 硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com