
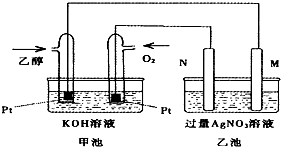
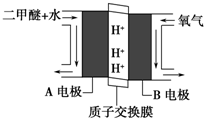
| A. | 若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极 | |
| B. | 甲池中负极的电极反应式为:CH3CH2OH-12e-+3H2O=2CO2+12H+ | |
| C. | 甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g | |
| D. | M电极上的电极反应式为:Ag++e-=Ag |
分析 甲池为乙醇燃料电池,通入乙醇的电极是负极,负极上乙醇失电子生成碳酸根离子,通入氧气的电极是正极,正极上氧气得电子生成氢氧根离子,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,阴极上银离子得电子生成Ag,结合原电池和电解池原理分析.
解答 解:A.若用此装置给铁棒上镀上层银,则阴极为铁电极,阳极为银电极,即N电极改用银电极,M电极改用铁电极,故A错误;
B.碱性条件下,乙醇电极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H5OH-12e-+16OH-=2CO32-+11H2O,故B错误;
C.甲池KOH溶液中经过0.05mol电子时,则理论上乙池转移电子也是0.05mol,所以M电极析出的银为0.05mol,即质量增加5.4g,故C错误;
D.M是阴极,阴极上银离子得电子生成Ag,则M电极上的电极反应式为:Ag++e-=Ag,故D正确;
故选D.
点评 本题考查燃料电池和电解原理的应用,侧重考查基本概念、电池反应式的书写,题目难度中等,注意电子守恒在计算中的应用.


科目:高中化学 来源: 题型:解答题
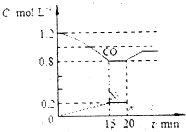 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
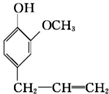 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: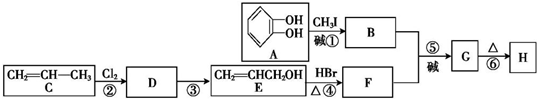
 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$ +HX(X代表卤素原子);
+HX(X代表卤素原子); .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
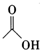 +
+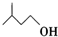 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ 
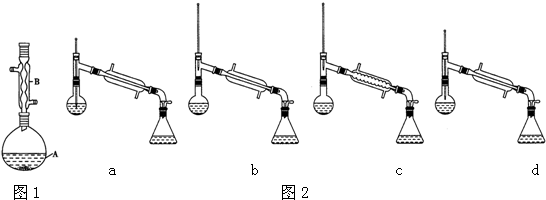
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由题目信息知:KMnO4的氧化性比MnO2的强 | |
| B. | 制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 | |
| C. | 用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 | |
| D. | 用足量MnO2与含有4 molHCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40Wg | B. | 80ng | C. | 5(m-n)g | D. | mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.
(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com