
【题目】铅及其化合物用广泛,请回答下列相关问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅元素的原子结构示意图为____________;相同温度下,同浓度的![]() 溶液和
溶液和![]() 溶液中水的电离程度___________(填“前者大”“后者大”或“一样大”)。
溶液中水的电离程度___________(填“前者大”“后者大”或“一样大”)。
(2)工业上利用锌冶炼过程中的铅浮渣(主要成分是![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
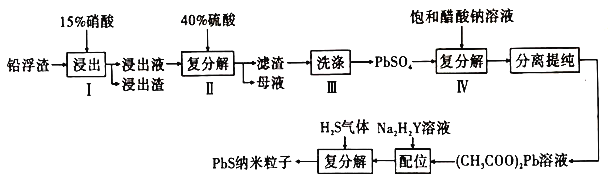
已知:a.25℃时,![]() ,
,![]() ,
,![]() 。
。
b.![]() 二钠简写成
二钠简写成![]() ,可以与
,可以与![]() 及其他许多金属离子形成稳定的配离子。
及其他许多金属离子形成稳定的配离子。
①已知步骤Ⅰ有![]() 产生,
产生,![]() 被足量稀硝酸氧化成
被足量稀硝酸氧化成![]() 。写出
。写出![]() 参加反应的离子方程式:________。
参加反应的离子方程式:________。
②步骤Ⅰ需控制硝酸的用量并使![]() 稍有剩余,原因是_________________________。
稍有剩余,原因是_________________________。
③硫酸铅微溶于水,醋酸铅易溶于水,步骤Ⅳ能发生反应的原因是____________________。
④不用硫化氢气体直接通入![]() 溶液来制备
溶液来制备![]() 纳米粒子的原因是__________________。
纳米粒子的原因是__________________。
⑤已知铅蓄电池工作时会产生![]() ,则铅蓄电池
,则铅蓄电池![]() 充电时的阳极反应式为________________________________。
充电时的阳极反应式为________________________________。
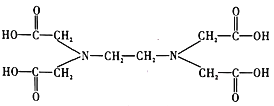
⑥![]() 又名乙二氨四乙酸,是一种弱酸(结构如图),在水溶液中可形成内盐(总电荷为0,电中性的化合物,但是带正电和负电的原子不同)。据此写出
又名乙二氨四乙酸,是一种弱酸(结构如图),在水溶液中可形成内盐(总电荷为0,电中性的化合物,但是带正电和负电的原子不同)。据此写出![]() 的结构:_________________。
的结构:_________________。
【答案】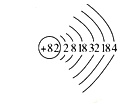 前者大
前者大 ![]() 防止
防止![]() 被溶解进入溶液(或使
被溶解进入溶液(或使![]() 留在浸出渣中)
留在浸出渣中) ![]() 是一种弱电解质,强电解质可以制弱电解质 溶液中
是一种弱电解质,强电解质可以制弱电解质 溶液中![]() 浓度很大,
浓度很大,![]() 很小,直接通
很小,直接通![]() 时,致使
时,致使![]() 的粒子较大,不能形成
的粒子较大,不能形成![]() 纳米粒子
纳米粒子 ![]()
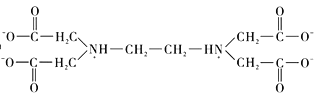
【解析】
(1)既然和碳同族,铅的最外层应该也有4个电子,画出其电子排布即可,水解性盐可以增强水的电离程度,而水解强弱遵循“越弱越水解”的规律;
(2)铅和硝酸发生氧化还原反应,得到![]() ,二氧化铅溶于酸得到
,二氧化铅溶于酸得到![]() ,
,![]() 和铅归中也得到
和铅归中也得到![]() ,硝酸被还原为氮氧化物,加入硫酸得到硫酸铅白色沉淀,后续步骤图中写得比较明确,据此来判断可题即可;
,硝酸被还原为氮氧化物,加入硫酸得到硫酸铅白色沉淀,后续步骤图中写得比较明确,据此来判断可题即可;
(1)根据铅是碳的同族元素,比碳多4个电子层,根据核外电子排布规律,画出铅元素的原子结构示意图为 ;根据同族元素性质的递变规律知,非金属性碳强于铅,故
;根据同族元素性质的递变规律知,非金属性碳强于铅,故![]() 酸性强于
酸性强于![]() ,
,![]() 水解程度大于
水解程度大于![]() ,水解促进水的电离,故同浓度的
,水解促进水的电离,故同浓度的![]() 溶液和
溶液和![]() 溶液中水的电离程度前者大;
溶液中水的电离程度前者大;
(2)①![]() 和硝酸的反应类似于铜与稀硝酸的反应,结合提示有
和硝酸的反应类似于铜与稀硝酸的反应,结合提示有![]() 产生,得离子方程式:
产生,得离子方程式:![]() ;
;
②铅浮渣中含有![]() ,
,![]() 也会和硝酸反应,控制硝酸的用量并使
也会和硝酸反应,控制硝酸的用量并使![]() 稍有剩余,可防止
稍有剩余,可防止![]() 被溶解进入溶液(或使
被溶解进入溶液(或使![]() 留在浸出渣中),起到了分离杂质的作用;
留在浸出渣中),起到了分离杂质的作用;
③一般认为绝大多数盐都是强电解质,硫酸铅是强电解质,有极少数盐例外,![]() 就是一个弱电解质,由强电解质制弱电解质自然是可以发生的;
就是一个弱电解质,由强电解质制弱电解质自然是可以发生的;
④![]() 的
的![]() 很小,易沉淀,硝酸铅溶液中
很小,易沉淀,硝酸铅溶液中![]() 浓度很大,直接通
浓度很大,直接通![]() 时,致使
时,致使![]() 的粒子较大,不能形成
的粒子较大,不能形成![]() 纳米粒子,而形成
纳米粒子,而形成![]() 后,游离的
后,游离的![]() 浓度减小;
浓度减小;
⑤铅蓄电池阳极材料为二氧化铅,充电时阳极失电子,由硫酸铅变回二氧化铅,因此电极反应为![]() ;
;
⑥根据两性离子(内盐)的提示,结合氨气与氢离子的反应,可推知![]() 中羧基上的氢可以转移至氮原子上形成内盐,故
中羧基上的氢可以转移至氮原子上形成内盐,故![]() 的结构为
的结构为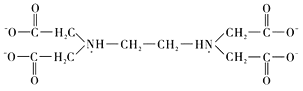 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、足量的CuSO4溶液和足量的 K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加6.4g。以下说法不正确的是:
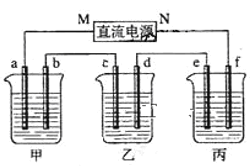
A.电源的N端为正极
B.电极b上发生的电极反应为4OH--4e-=2H2O+O2↑
C.b电极上生成气体1.12L,e电极上生成气体0.2 g
D.如果电解过程中铜全部析出,此时电解继续进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
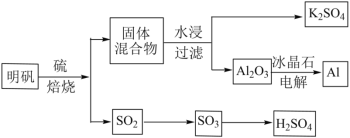
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
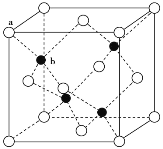
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:
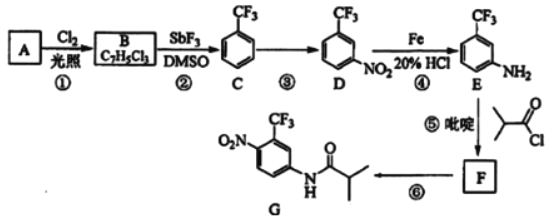
回答下列问题:
(1)A的结构简式为__。C的化学名称是__。
(2)③的反应试剂和反应条件分别是__,该反应的类型是__。
(3)⑤的反应方程式为__。吡啶是一种有机碱,其作用是__。
(4)G的分子式为__。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__种。
(6)4甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应: A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量
⑤混合气体的平均相对分子质量 ⑥混合气体的总质量 ⑦C、D的浓度之比等于化学计量数之比
A.全部B.①③④⑤C.②③④⑤D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容绝热(不与外界交换能量)容器中进行2A(g) +B(g) =2C(g)+D(s)反应,按下表数据投料,反应10 s后达到平衡状态,测得体系压强升高,前10s内v(A)= 0.025 mol/(Ls)。下列说法正确的是

A. 达平衡时,2v正(A)=v逆(B) B. 平衡后,增加D的量,平衡逆向移动
C. 到达平衡时,n(B) =0.5 mol D. 温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
请回答下列问题:
(1)邻氨基吡啶(![]() )的铜配台物在有机不对称合成中起催化诱导效应。
)的铜配台物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性出小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为__杂化。
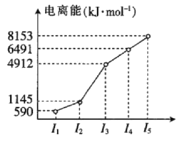
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为___。
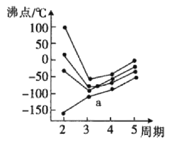
(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表-种氢化物,则趋势线a代表第__族元素的最简单氢化物的沸点变化趋势,判断依据是__。
(4)干冰是常见的分子晶体,而CO2在高温高压下能形成另一种晶体其晶胞如图所示,该CO2晶体的熔点__(填“>”“<”或“=”)SiO2晶体的熔点。
(5)一种嘌呤和一种吡啶的结构如图。
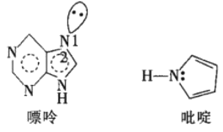
①嘌呤中轨道之间的夹角∠1比∠2大,原因是__。
②分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
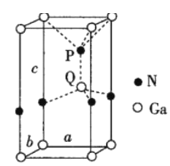
(6)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=___nm(写出代数式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com