
| A、0.24 mol |
| B、0.21 mol |
| C、0.25 mol |
| D、0.14 mol |
| 2.24L |
| 22.4L/mol |
| 0.5mol |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
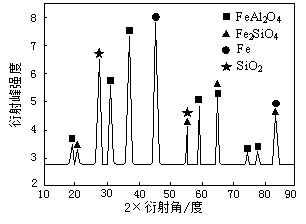
 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: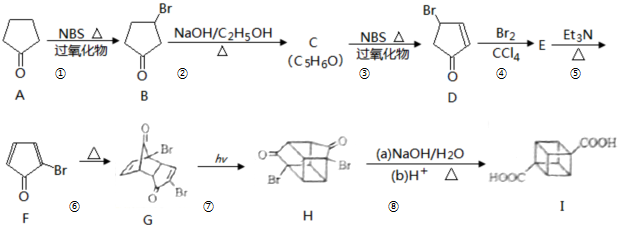

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
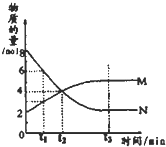 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t3后,若升高温度则反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
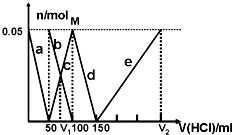 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B、V1:V2=1:4 |
| C、M点时生成的CO2为0mol |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )| A、Be常温下能与水反应 |
| B、Be(OH)2受热不会分解 |
| C、BeO易与水反应 |
| D、Be(OH)2能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、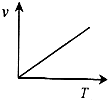 |
B、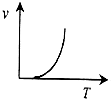 |
C、 |
D、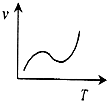 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com