
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.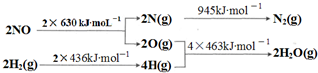
| 消耗量 |
| 起始量 |
| 52.29% |
| 40 |
| 46.41% |
| 35.5 |
| 1-52.29%-46.41% |
| 1 |
| 0.8mol/L |
| 1.0mol/L |
| C(H 2O) 2C(CH 4) |
| C(CO 2)C(H 2) 4 |
| 1.6 2×0.8 |
| 0.2×0.8 4 |
| C(H 2O) 2C(CH 4) |
| C(CO 2)C(H 2) 4 |
| 52.29% |
| 40 |
| 46.41% |
| 35.5 |
| 1-52.29%-46.41% |
| 1 |


科目:高中化学 来源: 题型:
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

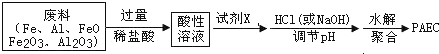
查看答案和解析>>
科目:高中化学 来源: 题型:
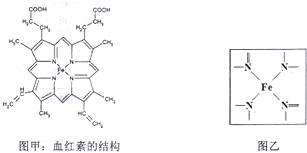

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
| B、向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强 |
| C、向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀.证明葡萄糖中不含醛基 |
| D、检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com