
| ʵ�鲽�� | Ԥ����������� |
| ȡ������Ӧ����Һ����A��B��֧�Թ��У� ��A�Թ��еμ�KSCN�� ��B�Թ��еμӵ��ۣ� | ����A���ɫ�� B����ɫ�����1���� ����A����ɫ�� B����ɫ�����2���� ����A���ɫ�� B����ɫ�����3���� |
���� ��1����������衿����ʵ���Ŀ�ģ�̽��Fe2+��I-�Ļ�ԭ��ǿ���ó��������ݣ�Fe2+��ԭ�Ա�I-ǿ��I-��ԭ�Ա�Fe2+ǿ��
����֤���衿
��2������ʵ���Ŀ�ġ�������Cl2ͨ��Fe2+��I-�Ļ����Һ�У�̽��Fe2+��I-�Ļ�ԭ��ǿ����������������
��3����ˮ����ɫ������������ˮ��Һ����ɫ����
��4����������������KSCN��Һ�Ժ�ɫ���������������ɫ����ͨ������������ʱ����������������ȷ�Ӧ�����������������ӣ������KSCN��Һ�Ժ�ɫ��
�����Ӵ�ʱΪ��Ӧ��������ۺ���ɫ������������ȷ�Ӧ������Ϊ���ʵ⣬�������۱���ɫ�����������Ӵ�ʱδ��Ӧ������KSCN��Һ�����ɫ��
��5������2Fe2++Cl2=2Fe3++2Cl-����1.52g FeSO4�����ж��������ӱ�������Ҫ�����������ʵ���������2I-+Cl2=I2+2Cl-������1.66g KI���屻������Ҫ�����������ʵ�����
��6������������ԭ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�����ش�
��� �⣺��1����������衿����ʵ���Ŀ�ģ�̽��Fe2+��I-�Ļ�ԭ��ǿ���ó��������ݣ�Fe2+��ԭ�Ա�I-ǿ��I-��ԭ�Ա�Fe2+ǿ��
�ʴ�Ϊ��Fe2+��ԭ�Ա�I-ǿ��I-��ԭ�Ա�Fe2+ǿ��
����֤���衿
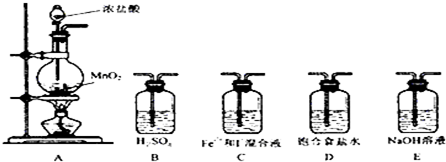
��2��Ҫ��̽��Fe2+��I-�Ļ�ԭ��ǿ����Ӧ����ȡ������ͨ�뵽����Fe2+��I-����Һ�У������ж�Ӧ����β�����������Ա����װ��A��C��E��
�ʴ�Ϊ��C��E��
��3����ˮ����ɫ������������ˮ��Һ����ɫ�������Բ���ͨ���۲���ɫ���ȽϷ�Ӧ���Ⱥ�˳�ʴ�Ϊ�����ܣ�
��4����������������KSCN��Һ�Ժ�ɫ���������������ɫ����ͨ������������ʱ����������������ȷ�Ӧ�����������������ӣ������KSCN��Һ�Ժ�ɫ��
�����Ӵ�ʱΪ��Ӧ��������ۺ���ɫ������������ȷ�Ӧ������Ϊ���ʵ⣬�������۱���ɫ�����������Ӵ�ʱδ��Ӧ������KSCN��Һ�����ɫ��
�ʴ�Ϊ��
| ʵ�鲽�� | Ԥ������ͽ��� |
| KSCN�� ���� | ��A���ɫ��B����ɫ ��A����ɫ��B����ɫ ��A���ɫ��B����ɫ |
���� ����Ϊʵ���⣬�����˶���������������ӻ�ԭ��ǿ���ıȽϣ���Ŀ�Ѷȴ���ȷ��Ӧ��ʵ�ʺ�������ԭ��Ӧ���Ⱥ�����ǽ���Ĺؼ���


 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | ���������� | ���� |
| A | ��0.1mol•L-1��ˮϡ�ͳ�0.01mol•L-1�����pH��11.1��� 10.6 | ϡ�ͺ�NH3•H2O�ĵ���̶����� |
| B | �����£���ñ���Na2CO3��Һ��pH���ڱ���NaHCO3��Һ | ������ˮ��̶ȣ�CO32-��HCO3- |
| C | ��25mL��ˮ�ͷ�ˮ�зֱ����5��FeCl3������Һ��ǰ��Ϊ��ɫ������Ϊ���ɫ | �¶����ߣ�Fe3+��ˮ��̶����� |
| D | ���������ھ�ˮ | ������ˮ��ˮ�����ɵ��������������������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���ᷴӦ��2Fe+6H+��2Fe3++3H2�� | |
| B�� | Al��ϡH2SO4��Al+2H+��Al3++H2�� | |
| C�� | ƫ��������Һ�мӹ���HCl��AlO2-+4H+=Al3++2H2O | |
| D�� | �Ȼ�����Һ�мӰ�ˮ��Al3++3OH-��Al��OH��3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��3 | B�� | 3��1 | C�� | 1��4 | D�� | 1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol���κ������ж�����6.02��1023������ | |
| B�� | 12g12C�к���6.02��1023��̼ԭ�� | |
| C�� | 1molˮ�к���6.02��1023����ԭ�� | |
| D�� | ���ʵ�����ȵ�CO��CO2������Cԭ�Ӹ���Ҳ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com