
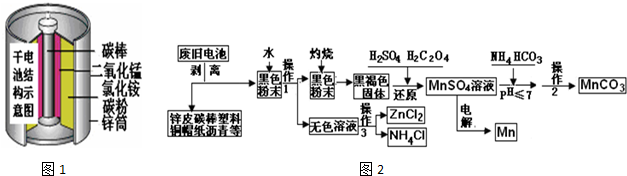
分析 (1)废旧锌锰干电池剥离出的黑色粉末水浸后过滤分离得到黑色粉末含有含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰;
(2)还原过程中草酸将二氧化锰还原成硫酸锰;根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰;
(3)操作1和操作2都是分离固体和液体;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生,生成了二氧化碳;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰.
解答 解:(1)废旧锌锰干电池剥离出的黑色粉末水浸后过滤分离得到黑色粉末含有含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰,反应的化学方程式为2MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2MnO+CO2↑或MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑,
故答案为:2MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2MnO+CO2↑或MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑;
(2)还原过程中草酸将二氧化锰还原成硫酸锰,反应方程式为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O,根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,比较甲、乙两位组员实验可得出的结论是酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2,
故答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;Mn2++H2O2+2OH-=MnO2↓+2H2O;酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2;
(3)操作1和操作2都是分离固体和液体,应采取过滤方法,
故答案为:过滤;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生,生成了二氧化碳,反应离子方程式为:Mn2++2HCO3 -=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3 -=MnCO3↓+CO2↑+H2O;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电极反应式为:MnO2+NH4++e-=MnO(OH)+NH3,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,阳极的电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O),
故答案为:MnO2+NH4++e-=MnO(OH)+NH3;2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O).
点评 本题属于化学工艺流程题目,题目涉及方程式的书写、电极反应式的书写、氧化还原反应等知识,侧重考查学生对原理的分析理解、信息获取与迁移应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
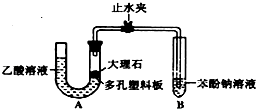 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.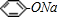 溶液
溶液查看答案和解析>>
科目:高中化学 来源: 题型:解答题
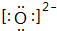 .
.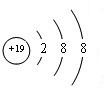 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com