
| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
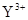 与
与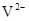 的核外电子数相等
的核外电子数相等 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.I元素的相对原子质量为131 | B.131I可治疗地方性甲状腺肿大 |
| C.131I与127I两核素互为同位素 | D.某溶液中通入过量Cl2,再加入淀粉溶液不变蓝,证明其中没有I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最外层有2e-一定在ⅡA |
| B.Na2O2中阴阳离子个数比为1:1 |
| C.CO2各原子最外层都满足8e-的稳定结构 |
| D.ⅦA的氢化物的熔沸点随着相对分子质量的增加而逐渐升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子中一定含有化学键 | B.共价化合物一定不含离子键 |
| C.含有金属元素的离子一定是阳离子 | D.非金属元素的化合物一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只含有共价键的物质属于共价化合物 |
| B.所有物质中均含有化学键 |
| C.含有离子键的物质肯定含金属元素 |
| D.只要含离子键的化合物就属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.XY | B.XY2 | C.X2Y | D.X2Y3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
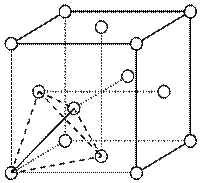
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com