
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与硫酸的反应: OH+H+=H2O
B.铜片插入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag
C.碳酸钙溶于稀盐酸中: CaCO3+2H+=Ca2++H2O+CO2
D.铁与稀硫酸反应:2Fe +6H+ = 2Fe2+ + 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将 1 mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H 3。则下列判断正确的是( )
A. △H2>△H3
B. △H1<△H3
C. △H1+△H3=△H2
D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,32gCH4和22.4LCO2的密度之比为_______;物质的量之比为______。
(2)将20gNaOH溶于水得2L溶液,则该NaOH溶液的物质的量浓度为_________;若从中取出100mLNaOH溶液,其中含有的Na+与____molNa2CO3含有的Na+数目相同。
(3)已知标准状况下,现有四种物质:
A.49g H2SO4 B.6.02×1023个H2O C.44.8L CO和CO2混合气体 D.6g H2
其中所含分子物质的量最小的是____________(填字母);所占体积最大的是________(填字母);若C中气体重量为64g,则该混合气体中CO和CO2的体积比为__________________。
(4)标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρ g·mL-1,则所得盐酸溶液中溶质的物质的量为________________,溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2![]() 2NO2。其中NO的物质的量[n(NO)]随时间的变化如下表:
2NO2。其中NO的物质的量[n(NO)]随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示达到平衡(假设30 s刚刚达到平衡)时反应速率________,0~10 s与10~20 s的反应速率之比为________。
(2)根据上述数据,能否计算800℃时该反应的平衡常数K________,“能”则计算K,“否”则说明缺少的数据:________。
(3)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(4)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL 0.2mol/L的NaOH溶液。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_____________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________、____________。
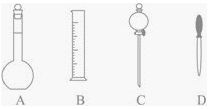
(2)填写下述过程中的空白;
具体步骤如下:
①计算需要称量NaOH固体的质量___________g;
②用托盘天平称量NaOH固体;
③将称好的NaOH固体放入烧杯中,加适量蒸馏水溶解、搅拌,并_________至室温;
④将NaOH溶液沿玻璃棒注入____________中;
⑤用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;
⑥将蒸馏水注入容量瓶,液面离刻度线下_______cm时,改用____________滴加蒸馏水至液面于刻度线相切;
⑦盖好瓶塞,反复上下颠倒,摇匀;
(3)经精确测量,最后所得溶液物质的量浓度为0.192mol/L,原因可能是_____________
A.使用滤纸称量NaOH固体;
B.溶解NaOH后的烧杯未经多次洗涤;
C.容量瓶中原来有少量蒸馏水;
D.称量时所用的砝码生锈;
E.未冷却直接转移至容量瓶,立即配好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为__L,它与标准状况下__L硫化氢含有相同数目的氢原子。
(2)同温同压下,SO2与氦气的密度之比为___;若质量相同,则两种气体的体积之比为___;若体积相同,两种气体的质量之比为___。
(3)在标准状况下,①4gH2;②11.2LO2;③1molH2O中,所含分子数最多的是(填序号,下同)___,含原子数最多的是___,质量最大的是___,体积最小的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
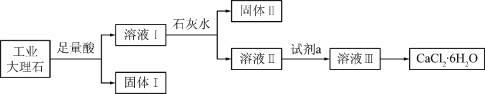
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com