
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OHˉ+HCO3ˉ+Ca2+=CaCO3↓+H2O | |
| C. | 钠和冷水反应:2Na+2H2O=2 Na++2OHˉ+H2↑ | |
| D. | 过量的CO2和氢氧化钙溶液的反应 OHˉ+CO32-=HCO3ˉ |
分析 A.不符合反应客观事实;
B.碳酸氢钠少量反应生成碳酸钙、氢氧化钠和水;
C.二者反应生成氢氧化钠和氢气;
D.过量二氧化碳与氢氧化钙反应生成碳酸氢钙.
解答 解:A.铁和稀硫酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故A错误;
B.少量NaHCO3溶液与Ca(OH)2溶液反应,离子方程式:OHˉ+HCO3ˉ+Ca2+=CaCO3↓+H2O,故B正确;
C.钠和冷水反应,离子方程式:2Na+2H2O=2 Na++2OHˉ+H2↑,故C正确;
D.过量的CO2和氢氧化钙溶液的反应,离子方程式:OHˉ+CO2=HCO3ˉ,故D错误;
故选:BC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解、氧还原反应及分析与应用能力的考查,题目难度中等,注意反应物用量对反应产物的影响.


科目:高中化学 来源: 题型:解答题
 如图是一个电化学过程的示意图.
如图是一个电化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
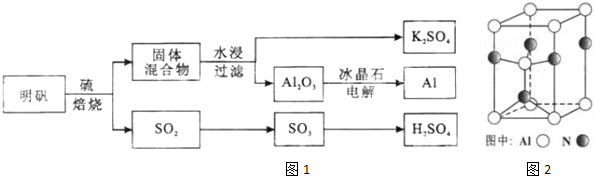
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子 | 键长(1.0×10-10m) | 键能(kJ•mol-1) |
| O22- | 1.49 | a |
| O2- | 1.28 | b |
| O2 | 1.21 | c=494 |
| O2+ | 1.12 | d=628 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4LHF中所含电子数为10NA | |
| B. | 100mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| C. | 1mol•L-1 Na2CO3溶液中,CO32-的数目小于NA | |
| D. | 1 mol CH5+中含有的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
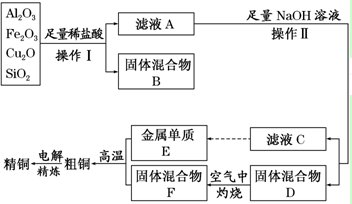
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 购物时用布袋代替塑料袋 | B. | 农田过量施用农药、化肥 | ||
| C. | 工厂的废水经处理后再排放 | D. | 城市推广使用氢燃料电池客车 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com