
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
分析 (1)越是活泼的金属,和酸或者水反应越剧烈,置换出氢气越容易,生成碱的碱性越强;
(2)Na与水反应生成氢氧化钠和氢气;
(3)根据以上反应现象判断金属钠、镁、铝的活动性顺序;
(4)从原子半径和失电子能力角度来解释金属性强弱关系.
解答 解:(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,所以:1对应的现象为②、2对应的现象为④、3对应的现象为①、4对应的现象为③,
故答案为:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | ② | ④ | ① | ③ |
点评 本题考查学生同一周期元素性质的递变规律知识,题目难度不大,试题结合试验的方式考查,增加了题目的处理难度,注意熟练掌握元素周期律的内容及其应用.


科目:高中化学 来源: 题型:解答题
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴 加酚酞. | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞.镁带用砂纸打磨后与2mol/L盐酸反应. | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| 探究同一周期从左到右元素 金属性的递变规律 | 探究同一主族内从上到下元素 非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数d>c>b>a | B. | 离子半径C2->D->B+>A2+ | ||
| C. | 原子半径A>B>C>D | D. | 非金属性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
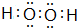 ,所含的化学键类型为共价键.
,所含的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.02mol•L-1 | D. | 20 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com