
【题目】氨气在工农业生产中有重要应用。
(1)氨的催化氧化是工业生产硝酸的基础,写出该化学方程式_________。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:
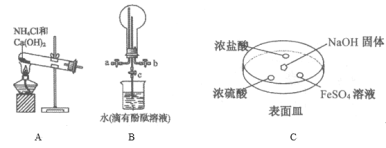
①用装置B收集氨时,氨的进气口是__(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,______。
②向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现 _____,(填现象)发生反应的化学方程式为_______。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_________。
③为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的__(填序号)。
【答案】4NH3+5O2![]() 4NO+6H2O a 极易溶于水 溶于水形成的溶液呈碱性 白烟 NH3+HCl=NH4Cl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 BD
4NO+6H2O a 极易溶于水 溶于水形成的溶液呈碱性 白烟 NH3+HCl=NH4Cl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 BD
【解析】
(1)氨的催化氧化生成NO和水;
(2)①根据氨气的水溶性和氨气的密度来确定氨气收集方法-向下排空气法;氨气极易溶与水,能产生喷泉现象,溶于水的氨气反应生成一水合氨,一水合氨是弱碱,电离产生氢氧根离子,具有碱性;
②浓盐酸和浓氨水易挥发,浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵;氨气与硫酸亚铁溶液反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,以此解答;
③氨气极易溶于水,可用水吸收氨气,注意防到吸。
(1)氨催化氧化生成NO和水,发生反应的化学方程式是4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①因为氨气极易溶于水,只能用排气法收集,又因为氨气的密度小于空气的密度,所以应该选择向下排空气法收集,氨气从a口进入空气从b口排出;能够形成喷泉实验是因为氨气极易溶于水这一物理性质,产生红色喷泉是因为氨气溶于水后与水反应生成弱碱一水合氨具有碱性;
②浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵,该反应为NH3+HCl═NH4Cl;FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③氨气极易溶于水,可用水吸收氨气,但是应该注意防止倒吸,BD都具有防倒吸功能,可以用来吸收氨气,故答案为:BD。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是( )
A.用图 所示装置分离乙醇和碘的混合液
所示装置分离乙醇和碘的混合液
B.用图 所示操作配制100 mL 0.1 mol·L-1硫酸溶液
所示操作配制100 mL 0.1 mol·L-1硫酸溶液
C.用图 所示装置制取氯气
所示装置制取氯气
D.用图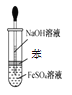 所示装置不能制取Fe(OH)2
所示装置不能制取Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂,某课外小组测定该补血剂中铁元素的含量.实验步骤如下::

请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为______________。步骤③中反应的化学方程式为_____________________。
(2)步骤④中一系列处理的操作步骤:___________、洗涤、___________、冷却、称量.
(3)实验中需用98%浓硫酸(密度1.84g/mL)配制1mol/L的稀硫酸480mL,配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有___________,需用量筒量取浓硫酸________mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量___________g(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含溴化氢的废液中提取溴单质,下列装置能达到实验目的的是( )
A. 氧化废液中的溴化氢
氧化废液中的溴化氢
B. 分离CCl4和水层
分离CCl4和水层
C. 分离四氯化碳和液溴
分离四氯化碳和液溴
D. 密封存放单质溴
密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在500 ℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3 和SO2)。下列说法正确的是

A. 取装置①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
C. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液.某研究小组用该含碘废液制备NaI固体,实验流程如下:

已知:反应②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列问题:
(1)产生含碘废液的离子方程式为____________。
(2)①中I2与Na2SO3溶液反应的离子方程式为_________。
(3)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近报道的一种处理垃圾渗滤液并用其发电的示意图如下。装置工作时,下列说法不正确的是

A. 盐桥中Cl-向Y极移动
B. 化学能转变为电能
C. 电子由X极沿导线流向Y极
D. Y极发生的反应为2NO3-+10e-+12H+=N2+6H2O,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种常见元素且原子序数依次增大:A元素的一种原子的原子核内没有中子,B的基态原子2p轨道中有三个未成对电子,C是所有元素中电负性最大的元素,D是短周期且最外层只有一个未成对电子的非金属元素,E是主族元素且与F同周期,其最外能层上有两个运动状态不同的电子,F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。请回答下列问题:
(1)写出F元素原子基态时价层的电子排布式___
(2)B元素的第一电离能比氧元素的第一电离___(填“大”或“小”),原因是____
(3)C元素与A元素形成的最简单氢化物比D元素与A元素形成的氢化物沸点高,原因是____。
(4)与E元素同周期且未成对电子数最多的元素的价层电子排布图___。
(5)A、B、F三种元素可形成[F(BA3)4]2+配离子,其中存在的化学键类型有____(填字母)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[F(BA3)4]2+配离子具有对称的空间构型, 且当[F(BA3)4]2+中的两个BA3被两个Br-取代时,能得到两种不同结构的产物,则[F(BA3)4]2+的空间构型为___(填字母)。
a.平面正方形 b.正四面体形 c.三角锥形 d.V形
(6)D元素形成四种常见的含氧酸酸性由小到大的顺序___,且原因是___
(7)C和E能够形成化合物M,其晶胞结构如图所示,晶胞参数![]() ,求晶体M的密度(
,求晶体M的密度(![]() )____。(只列表达式即可)
)____。(只列表达式即可)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com