
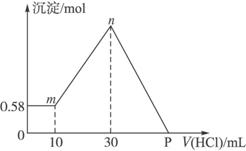
图4-7
(1)混合物中NaOH的质量是_________g;AlCl3的质量是_________g;MgCl2的质量是_________g。
(2)P点所表示盐酸加入体积是_________ mL。
解析:由图可知,加入盐酸,开始无沉淀,后来才有沉淀产生,说明氢氧化钠在与AlCl3全部反应生成Na[Al(OH)4]后还有剩余,则可判断0.58 g沉淀为Mg(OH)2,物质的量为0.01 mol,所以原MgCl2也是0.01 mol,质量为0.95 g。图中mn段发生的反应是:
Na[Al(OH)4]+HCl![]() Al(OH)3↓+NaCl+H2O
Al(OH)3↓+NaCl+H2O
由方程式可看出:
n(HCl)=n〔Al(OH)3〕=n(Al)=0.5 mol·L-1×(0.030-0.010)L=0.01 mol
原AlCl3的质量为0.01 mol×133.5 g· mol-1=1.335 g
混合物中NaOH的物质的量是剩余的NaOH和AlCl3、MgCl2消耗的NaOH物质的量的总和n(NaOH)=0.5 mol·L-1×0.01 L+0.01 mol×4+0.01 mol×2=0.065 mol,则m(NaOH)=0.065 mol×40 g· mol-1=2.6 g。
P点时消耗的盐酸等于原NaOH的物质的量0.065 mol,此时盐酸的体积是V=?0.065 mol/0.5 mol·L-1=0.13 L=130 mL。
答案:(1)2.6 1.335 0.95 (2)130


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
 Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 把由NaOH、AlCl3与MgCl2三种固体组成的混合物溶于足量水中,有2.9g白色沉淀析出,向所得的浊液里逐滴加入2mol?L-1的盐酸,加入盐酸的体积和生成沉淀的质量关系如图所示.试判断p点所表示的加入盐酸的体积是( )
把由NaOH、AlCl3与MgCl2三种固体组成的混合物溶于足量水中,有2.9g白色沉淀析出,向所得的浊液里逐滴加入2mol?L-1的盐酸,加入盐酸的体积和生成沉淀的质量关系如图所示.试判断p点所表示的加入盐酸的体积是( )| A、135 mL | B、145 mL | C、155 mL | D、165 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58 g白色难溶物析出,向所得溶液中逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如右图所示:

(1)混合物中NaOH的质量是___________g,AlCl3的质量是___________g,MgCl2的质量为___________g。
(2)P点表示盐酸加入的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省师大附中度高一上学期期末考试化学试卷(带解析) 题型:计算题
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58克白色沉淀,在所得的浊液中逐渐加入0.5mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如下图所示 。
回答下列问题:
①混合物中NaOH质量为 ; ②混合物中AlCl3的物质的量为 ;
③混合物中MgCl2的物质的量为 ;④P点所示的盐酸体积为 。
查看答案和解析>>
科目:高中化学 来源:2010年甘肃省高二11月月考化学试卷 题型:填空题
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀生成,向所得滤液(滤出0.58g沉淀),逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示[图中的Y表示沉淀质量(g), x表示加入盐酸体积(mL)]
(1) 混合物中NaOH质量是____________g(2`),
MgCl2和AlCl3的物质的量之比是________(2`)
(2) P点所表示的加入盐酸的体积为________ml.(2`)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com