
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO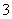 +4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
+4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
【答案】22. (8分)(1)14HNO3+3Cu2O===6Cu(NO3)2+2NO↑+7H2O(2分)
(2)酸性 氧化性(2分)
(3)0.6 (2分) (4)使用了较浓的硝酸,产物中有部分二氧化氮生成(2分)
【解析】
试题分析:(1)KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,具有氧化性,只有Cu2O中Cu处在较低价,具有还原性,在NO3-+4H++3e→NO+2H2O中发生氧化剂被还原的反应,则该氧化还原反应为Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,Cu元素由+1价升高到+2价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O,(2)因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸与硝酸中N元素的化合价相同,则体现硝酸具有酸性,所以,反应中硝酸体现了氧化性、酸性的性质;(3)由反应可知,NO为0.2mol,由2NO~6e-则,0.2molNO生成时转移的电子数为0.6mol;(4)Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O ①,14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O ②,将②式子系数除以3得到14/3HNO3+Cu2O═2Cu(NO3)2+2/3NO↑+7/3H2O,可知用稀硝酸氧化1molCu2O需要2/3mol硝酸作氧化剂,用浓硝酸需要2mol硝酸作氧化剂,质量当然增加,使用浓硝酸,产物中有NO2生成.
考点:考查氧化还原反应以及氧化还原反应电子转移数目的计算与配平,硝酸的化学性质等知识。


科目:高中化学 来源: 题型:
向含有0.03 mol稀H2SO4和0.04 mol稀HNO3的混酸中加入1.92 g Cu,充分反应后得到无色气体(假设反应只有一种还原物),则收集到的气体在标准状况下的体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.78g 苯含有C=C双键的数目为3NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是( )
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D. NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)家用液化气的主要成分之一是丁烷,试写出表示丁烷燃烧热的热化学方程式:
(查阅资料:丁烷的燃烧 热ΔH=-2 900 kJ·mol-1)
热ΔH=-2 900 kJ·mol-1)
___________________________ _______________________________________
_______________________________________
(2)已知:C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1;
2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1,
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。
(1) 写出W的原子结构示意图: 。
(2) X、Y、Z和W的最高价氧化物的水化物的酸性由强到强的顺序是
(3) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
 (5) 将W的气态氢化物通入一定量的NaOH溶液中,在所得 溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
(5) 将W的气态氢化物通入一定量的NaOH溶液中,在所得 溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物之间相互转化时常伴随着颜色的变化,下列符合黑色―→红色变化的是( )
A.Cu(OH)2→CuO B.Cu→Cu2S
C.Cu2(OH)2CO3→CuO D.CuO→Cu2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com