
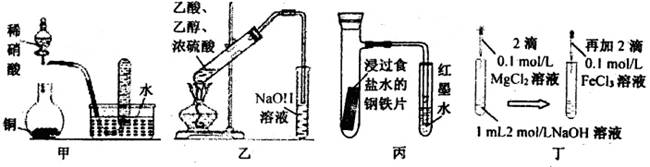
| A.甲图:验证铜与稀硝酸反应的气体产物只有NO |
| B.乙图:实验室制取乙酸乙酯 |
| C.丙图:验证钢铁片发生吸氧腐蚀 |
| D.丁图:证明在相同温度下Mg(OH)2的溶解度大于Fe(OH)3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。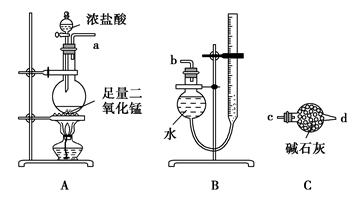
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
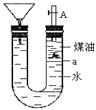
| A.此碱金属可能是钾或钠 |
| B.反应一段时间煤油会燃烧 |
| C.碱金属上下运动是由于与水反应产生了氢气 |
| D.若是金属锂则不能观察到上述现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
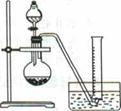
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
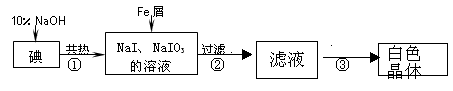
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 |  |
| 取少量溶液液于试管A中, . | 溶液显蓝色 | 溶液中含IO3一 |
| 另取少量溶液液于试管B中, . | . | 溶液中含大量0H一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验方法 | 解释或结论 |
| A | 检验CH2=CH-CHO中含碳碳双键 | 将丙烯醛溶液滴入溴水中,溴水褪色 | 丙烯醛中碳碳双键与溴单质发生了加成反应 |
| B | 确认某无机酸浓溶液的溶质 | 用蘸有浓氨水的玻璃棒放于试剂瓶口,有大量白烟 | 该无机酸一定为盐酸 |
| C | 鉴别一份红棕色气体成分 | 湿润的淀粉碘化钾试纸插入气体中,试纸变蓝 | 该气体一定为Br2 |
| D | 探究高级脂肪酸甘油酯水解的条件 | 高级脂肪酸甘油酯中加入NaOH溶液加热后不再分层 | 高级脂肪酸甘油酯发生皂化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
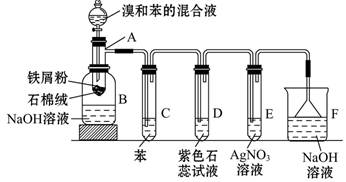
| A.蒸馏 | B.重结晶 | C.过滤 | D.萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com