
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
| A.V=44.8 | B.原样品中Fe元素的质量分数为38.89% |
| C.滤液A中的阳离子为Fe2+、Fe3+、H+ | D.样品中CuO的质量为4.0 g |
【答案】B
【解析】本题主要考查了氧化铁,单质铁,碱式碳酸铜,氧化铜等考点的理解。A、根据最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量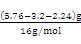 =0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,故A错误。B、固体为三氧化二铁,其物质的量为
=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,故A错误。B、固体为三氧化二铁,其物质的量为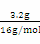 =0.02mol,铁元素的物质的量为0.02mol×2=0.04mol,质量为:0.04mol×56g/mol=2.24g,质量分数为
=0.02mol,铁元素的物质的量为0.02mol×2=0.04mol,质量为:0.04mol×56g/mol=2.24g,质量分数为 ,故B正确。C、生成的滤渣3.2g是铜,金属铜可以和三价铁反应,所以一定不含有+3价铁离子,故C错误。D、根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故D错误。
,故B正确。C、生成的滤渣3.2g是铜,金属铜可以和三价铁反应,所以一定不含有+3价铁离子,故C错误。D、根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故D错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
关于强弱电解质及非电解质的组合完全正确的是( )
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | 氨水 | HClO | HI |
| 非电解质 | Cl2 | 蔗糖 | C2H5OH | SO2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol•L﹣1•min﹣1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)= mol.
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (填“增大”或“减小”或“不变”),H2O的体积分数 (填“增大”或“减小”或“不变”).
(4)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同周期两种非金属元素X、Y,电负性X>Y,下列说法错误的是
| A.含氧酸的酸性:X对应的强于Y对应的 | B.气态氢化物的稳定性:HmX强于HnY |
| C.第一电离能可能Y大于X | D.X与Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某条件下,在2 L密闭容器中发生如下反应:2NO2(g)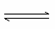 2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:

(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= 。该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1∶1组成的NO2与O2混合气体(保持温度不变),此时反应将向 (填“正反应”或“逆反应”)方向进行。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O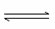 Al(OH)3↓+3
Al(OH)3↓+3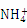 ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为 mol。
②d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如图-2。
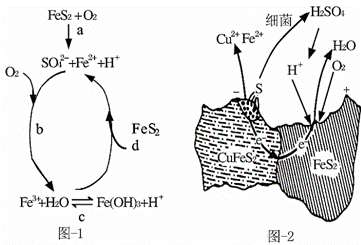
①冶炼过程中,正极周围溶液的pH (填“增大”、“减小”或“不变”)。
②负极产生单质硫的电极反应式为 。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
| FeS(s) + H2(g) | ΔH3 | K3 |
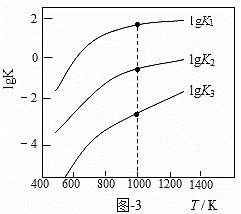
①上述反应中,ΔH1 0(填“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由水电离产生的c(H+)和c(OH﹣)的乘积为1×10﹣18的溶液里,可能大量共存的离子组( )
|
| A. | NH4+、Na+、Cl﹣、I﹣ | B. | Na+、K+、Fe3+、SCN﹣ |
|
| C. | Na+、Al3+、Cl﹣、AlO2﹣ | D. | Na+、K+、Cl﹣、HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液,一定呈中性的是( )
|
| A. | c(H+)=1×10﹣7mol/L的溶液 |
|
| B. | pH=pOH 的溶液 |
|
| C. | pH=14﹣pOH 的溶液 |
|
| D. | 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)RCH(OH)2→RCHO+H2O
(2)C2H5OH+HO﹣NO2(硝酸)→C2H5O﹣NO2(硝酸乙酯)+H2O
现有化合物A~E,其中A为饱和多元醇,C为硝酸酯,其他有关信息已注明在下图的方框内:
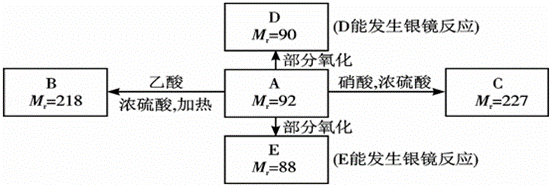
回答下列问题:
(1)A的分子式为 ;
(2)写出下列物质的结构简式:B ;D ;
(3)写出A→C的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com