
| A. | 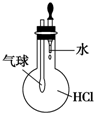 验证HCl的溶解性 | B. | 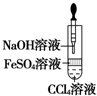 制备Fe(OH)2 | ||
| C. | 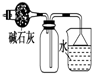 干燥并收集NH3 | D. | 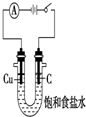 利用电解法制H2和Cl2 |
分析 A.氯化氢极易溶于水;
B.CCl4的密度比水大;
C.NH3是碱性气体,用碱石灰干燥;
D.电解饱和食盐水时石墨做阳极.
解答 解:A.氯化氢极易溶于水,溶于水后,压强减小使气球变大,故A正确;
B.CCl4的密度比水大,不能防止O2将Fe(OH)2氧化,故B错误;
C.NH3是碱性气体,用碱石灰干燥,这样收集气体集气瓶中排除的是空气,并可用倒扣的漏斗吸收尾气,能防止倒吸,故C正确;
D.电解饱和食盐水时石墨做阳极,阳极反应为2Cl--2e-=Cl2↑,阴极反应为2H++2e-=H2↑,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备、气体的收集和性质实验等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,71 g Cl2含有2 NA个Cl原子 | |
| B. | 把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol•L-1 | |
| C. | 物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+ | |
| D. | 常温常压下,11.2 L N2中含有的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 NaOH NaHCO3 | B. | Na2CO3 MgCl2 H2SO4 | ||
| C. | AlCl3 NH3•H2O NaOH | D. | Ba(OH)2 CaCl2 Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:KOH>NaOH>Mg(OH)2 | ||
| C. | 熔沸点:HI>HBr>HCl>HF | D. | 稳定性:HF>H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离苯和溴苯的混合物 | |
| B. | 装置②可用于吸收氨气,且能够防止倒吸 | |
| C. | 以NH4Cl为原料,装置③可用于制备NH3 | |
| D. | 剩用装置④可收集Cl2、H2等气体,盛满水时还能收集NO等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com