
按要求填空。
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________
Ⅱ:
1.硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因____________如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
2.稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应___________________________
III:依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100 mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1 mol•L-1的KMnO4溶液装入滴定管中,调节液面至8.00 mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00 mL
3.如何知道滴定到达终点?
4.下列操作会导致测定结果偏低的是
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
5.下列每种量器的数量不限,在上述实验中,必须使用的有
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管 E容量瓶
6.FeSO4的质量分数为
Ⅰ:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
Ⅱ:
1.Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊 应加入少量H2SO4 2.2Al3++3S2-+6H2O = 2Al(OH)3↓+3H2S↑
III:
3.溶液由浅绿色变为紫红色,且半分钟后不变则达到滴定终
4.C
5.ABDE
6.50%
【解析】Ⅰ:考查反应热的计算和热化学方程式的书写。反应热就是断键吸收的能量和相差化学键放出的能量的差值。因此该反应的反应热为3×436kJ/mol+9466kJ/mol-2×3×3916kJ/mol=-926kJ/mol,因此反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1。
Ⅱ:硫酸铜属于强酸弱碱盐,在溶液中铜离子水解生成氢氧化铜和硫酸。因为水解是吸热的,加热促使水解平衡向正反应方向移动,生成氢氧化铜沉淀,所以溶液会产生混浊。要想不产生混浊,则必须抑制铜离子的水解,因为水解显酸性,所以可以加入少量硫酸以抑制水解。
III:考查基本实验操作和有关计算。
(1)因为高锰酸钾溶液是显紫红色的,当溶液中的亚铁离子被完全氧化生成铁离子后,如果再加一滴酸性高锰酸钾溶液,则溶液的颜色将显紫红色,据此可判断终点。
(2)选项A中相当于稀释了标准液,则消耗标准液的体积将偏大,测定结果偏高。锥形瓶在滴定实验中是不允许用标准液润洗的,B的操作是正确的。滴定管的刻度自上而下是逐渐增大的,滴定前平视,读数不影响。滴定到终点后俯视,则读数将偏低,因此消耗的标准液体积偏低,测定结果偏低。选项D中相当于把这一滴液体计算到标准液中,实验测定结果偏高。
(3)样品需要称量和溶解并配制溶液,所以A、B、D均需要。酸性高锰酸钾溶液具有强氧化性,需要放在酸式滴定管中,D需要。
(4)根据实验可知消耗高锰酸钾是10.00ml,根据方程式可知10.0ml待测液中硫酸亚铁的物质的量是5×0.01L×0.1mol/L=0.005mol。所以FeSO4的质量分数为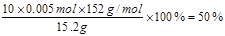 。
。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:022
按要求填空:
(1)用已准确称量的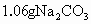 固体配制
固体配制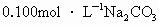 溶液100mL,所需的仪器为__________.
溶液100mL,所需的仪器为__________.
(2)除去 固体中混有的少量
固体中混有的少量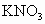 ,所进行的实验操作依次为:___________、蒸发、结晶__________.
,所进行的实验操作依次为:___________、蒸发、结晶__________.
(3)除去KCl溶液中的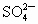 离子,依次加入的溶液为(填溶质的化学式):
离子,依次加入的溶液为(填溶质的化学式):
______________________________________.
查看答案和解析>>
科目:高中化学 来源:志鸿系列训练必修一化学人教版 人教版 题型:022
请按要求填空:
(1)用已准确称量的1.06 g Na2CO3固体配制0.100 mol·L-1Na2CO3溶液100 mL,所需要的仪器除烧杯、量筒之外,还有________.
(2)已知KNO3、KCl的溶解度如下:

现有KNO3和KCl混合物,按如下程序分离,请在[ ]中写出分离方法,在( )中写出化合物的化学式:

查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
请按要求填空:
(1)用已准确称量的1.06gNa2CO3固体配制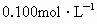
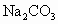 溶液100mL,所需要的仪器:______________________________________.
溶液100mL,所需要的仪器:______________________________________.
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为______、蒸发、结晶、_____________.
(3)除去KCl溶液中的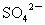 离子,依次加入的溶液为(填溶质的化学式):
离子,依次加入的溶液为(填溶质的化学式):
_____________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:022
请按要求填空:
(1)用已准确称量的1.06gNa2CO3固体配制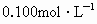
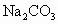 溶液100mL,所需要的仪器:______________________________________.
溶液100mL,所需要的仪器:______________________________________.
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为______、蒸发、结晶、_____________.
(3)除去KCl溶液中的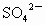 离子,依次加入的溶液为(填溶质的化学式):
离子,依次加入的溶液为(填溶质的化学式):
_____________________________________________________________.
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com