
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3。[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式是________________。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是__________、__________。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x =_______。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3的VSEPR模型名称为_____;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键_____。

【答案】 3s23p63d5 sp2 sp3 5 四面体 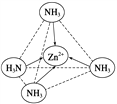
【解析】(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,基态Fe3+的M层电子排布式为3s23p63d5 ; ②由尿素分子的结构式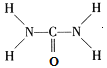 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;③ 配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5;(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。根据价层电子对互斥理论,配位体NH3价层电子对个数=3+
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;③ 配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5;(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。根据价层电子对互斥理论,配位体NH3价层电子对个数=3+![]() (5-3×1)=4,所以其VSEPR模型名称为正四面体;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,表示[Zn(NH3)4]2+中Zn2+与N之间的化学键如图:
(5-3×1)=4,所以其VSEPR模型名称为正四面体;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,表示[Zn(NH3)4]2+中Zn2+与N之间的化学键如图: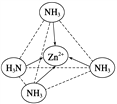 。
。


科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的说法和理解正确的是( )
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C. 国际上规定,0.012 kg碳原子所含有的碳原子数目为1 mol
D. 摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的![]() 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/cm3。
(1)此浓盐酸的物质的量浓度是多少?(列式计算)_________________
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)_____________
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号)_________________
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应N2O4(g)![]() 2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
①加压时(体积变小),将使正反应速率增大②保持体积不变,加入少许NO2,将使正反应速率减小;③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;④保持体积不变,升高温度,再达平衡时颜色变深 ⑤升高温度,正反应速率减小,平衡逆向移动
A. ①④⑤ B. ③④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+ b(g)![]() 2c(g)△H1<0
2c(g)△H1<0
x(g)+ 3y(g)![]() 2z(g)△H2 >0
2z(g)△H2 >0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第________周期第________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子价层电子排布式为________________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com