
以天然气为原料合成尿素的生产中的主要反应之一为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
请根据题目要求回答下列问题:
(1)在一定条件下,将0.05molCH4和0.10molH2O气放入容积2L的密闭容器中,20s时有0.01molCO生成,则H2的化学反应速率为 。
(2)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(3)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向正反应方向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出水蒸气
(4)在一定温度下,将1.0molCH4和2.0molH2O(g)通入某一恒压容器中,达到化学平衡时,混合气体共4.0mol,则CH4的转化率为 ;若其它条件不变,起始时加入amolCH4molH2O(g),c mol CO和d molH2达到平衡时,各组分体积分数与上述平衡完全相等,则ab和c满足的关系为 (用字母表示)。
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省绵阳市第三次诊断性考试理综化学试卷(解析版) 题型:填空题
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料 合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。

请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产 120t尿素理论上需要 CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________
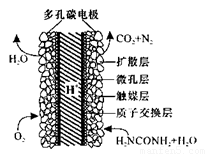
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com