
| A. | 合理开发利用可燃冰可缓解能源紧缺 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 明矾可用于自来水的消毒、杀菌 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是国际单位制中的七个基本物理量之一 | |
| B. | 阿伏加德罗常数是0.012kg 12C中所含的原子数 | |
| C. | 摩尔质量与物质的量的多少有关,它等于物质的质量除以物质的量 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
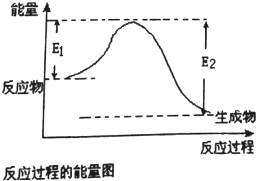 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: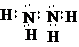 ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷在氯气中反应,1mol红磷失去的电子数一定为5NA | |
| B. | 标准状况下22.4L C3H8中含中子数为18NA | |
| C. | 1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个 | |
| D. | 常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{{V}_{ρ}-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$mol•L-1+c(H+) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com