
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
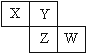 A.Z单质的化学活泼性一定比Y单质的强
A.Z单质的化学活泼性一定比Y单质的强
B.W的原子序数可能是Y的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.X和W两元素不可能形成共价化合物
科目:高中化学 来源: 题型:
在通风橱中进行下列实验:
| 步骤 |
|
| |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面产生红棕色气泡 |
下列说法中不正确的是:
A.Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断 Fe是否被氧化
Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
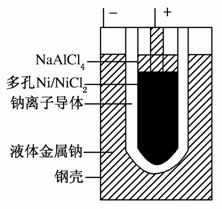
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O===2LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是

A.b>f
B.平衡常数K(1000℃)<K(810℃)
C.915℃,2.0MPa该反应的平衡常数为Kp=4.5MPa
D.1000℃,3.0MPa时E的转化率为83%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12。下列关于该温度下的叙述正确的是
A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小
B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
C.若向0.0008mol·L-1的K2CrO4溶液中加入等体积0.002 mol·L-1的AgNO3 溶液,则CrO42 --完全沉淀
D.若将0.001mol·L-1AgNO3 溶液滴入浓度均为0.001 mol·L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
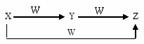 ①C 、CO ② S、SO2
①C 、CO ② S、SO2
③ AlCl3、Al(OH)3 ④Cl2、FeCl3
A.仅有①③ B.①②③
C.仅有②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:① Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
② C(s,石墨)+CO2(g)=2CO(g) ΔH 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
① 该反应的平衡常数表达式为K= 。
② 取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH (填“>”、“<”或“=”,下同)0。
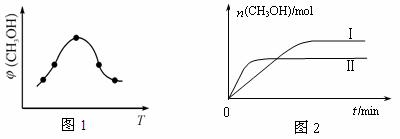
③ 在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ KⅡ。
(3)以CO2为原料还可以合成多种物质。
① 工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。开始以氨碳比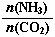 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
② 用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
③ 将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,则NH4HCO3溶液呈 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液不呈血红色 | 稀HNO3不能将Fe氧化为Fe3+ |
| B | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和AgNO3溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体33.6毫升(标准状况),反应消耗的HNO3的物质的量可能是 ( )
A.1.0×10-3摩尔 B.1.6×10-3摩尔
C.2.2×10-3摩尔 D.2.7×10-3摩尔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com