
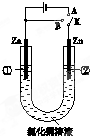
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、常温下氯气与水反应:Cl2+H2O══Cl-+ClO-+2 H+ |
| B、AlCl3溶液中加入足量的氨水:Al3++3NH3?H2O══Al(OH)3↓+3NH4+ |
| C、铁与稀硝酸反应:Fe+2H+══Fe2++H2↑ |
| D、大理石与盐酸反应:2H++CO32-══H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CHCl3中含有氯原子数目为3NA |
| B、7g CnH2n中含有的氢原子数目为NA |
| C、18g D2O中含有的质子数目为10NA |
| D、0.5mol/L Na2CO3 溶液中含有的Na+数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它是由不饱和烃乙的两个分子在一定条件下发生自身加成而得,在此反应中,除获得甲外,同时还获得了另一产物丙,丙是甲的同分异构体,则:乙的结构简式为
,它是由不饱和烃乙的两个分子在一定条件下发生自身加成而得,在此反应中,除获得甲外,同时还获得了另一产物丙,丙是甲的同分异构体,则:乙的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液 | ||
| B、c(H+)=1.0×10-7mol?L-1的溶液 | ||
| C、pH=7的溶液 | ||
D、c(H+)=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com