
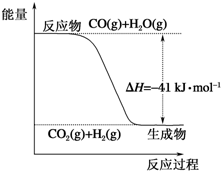
 (1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
(1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.分析 (1)图象分析反应物能量高于生成物的总能量,反应是放热反,标注物质聚集状态和对应反应的焓变,写出热化学方程式,由此分析解答;
(2)依据热化学方程式计算得到生成氢气物质的量;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)根据盖斯定律,将所给的反应通过加减乘除得到所要求的目标反应,反应热做相应的变化即可;
(5)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:(1)图象分析可知为放热反应,反应的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol,故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
(2)依据热化学方程式计算,若反应中释放了61.5kJ的热量,则
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol;
1mol 41KJ
n(H2) 61.5KJ
n(H2)=1.5mol,
故答案为:1.5;
(3)①2H2(g)+O2(g)=2H2O (g)△H=-484kJ/mol,
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41 kJ/mol
依据盖斯定律②×2+①得到:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol,
图中是1mol一氧化碳燃烧反应,热化学方程式为:CO(g)+$\frac{1}{2}$ O2(g)=CO2(g)△H=-283 kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$ O2(g)=CO2(g)△H=-283 kJ/mol;
(4)①N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1①
H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g),△H=-98kJ•mol-1②
H2O(l)═H2O(g),△H=+44kJ•mol-1③
将①+2②+4③可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=(-534kJ•mol-1)+2×(-98kJ•mol-1)+4×(+44kJ•mol-1)=-642 kJ•mol-1
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642 kJ•mol-1;
(5)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=4H2O+N2.
点评 本题考查了化学反应能量变化分析、图象判断和热化学方程式书写,掌握书写热化学方程式的基本要求是关键,题目较简单.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 测定次氯酸钠的pH | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,变色后,与标准比色卡对比 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴快速流出 |
| D | 取出分液漏斗中所需的上层液体 | 将下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,从分液漏斗下端管口继续放出下层液体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 用B表示的反应速率是0.3mol•L-1•min-1 | |
| C. | 2min末时的反应速率,用B表示为0.3mol•L-1•min-1 | |
| D. | 在这2min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用NaOH溶液吸收Cl2制得:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液与洁测灵(主要成分为HCl)混用,产生有毒Cl2:ClO-+Cl-+2H+═Cl2+H2O | |
| C. | 该消毒液滴加白醋可生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:A2+>B2+>C2+>D2+ | B. | 氧化性:D2+>C2+>B2+>A2+ | ||
| C. | 还原性:A>B>C>D | D. | 还原性:D>B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题:
过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol 氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol 氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比 1 mol H-H 键和1 mol F-F键的键能之和大546.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解饱和食盐水,阴极得2NA个电子时,阳极产生22.4 L气体 | |
| B. | 1mol二氧化硅晶体中含有2NA个硅氧键 | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 0.1L 3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com