
分析 FeCl3溶液为棕黄色,将白色粉末加水溶解,得无色溶液,所以一定不含有FeCl3,向①中中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,则一定含有碳酸氢钠和氯化钡,碳酸氢钠可以和氢氧化钠反应得到碳酸钠,碳酸钠可以和氯化钡反应生成碳酸钡白色沉淀,因存在BaCl2,则一定不存在K2SO4,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,即为氯化银沉淀,可通过焰色反应确定是否含有KCl,以此解答该题.
解答 解:FeCl3溶液为棕黄色,将白色粉末加水溶解,得无色溶液,所以一定不含有FeCl3,向①中中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,则一定含有碳酸氢钠和氯化钡,碳酸氢钠可以和氢氧化钠反应得到碳酸钠,碳酸钠可以和氯化钡反应生成碳酸钡白色沉淀,因存在BaCl2,则一定不存在K2SO4,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,即为氯化银沉淀,可通过焰色反应确定是否含有KCl,
(1)有以上分析可知白色沉淀A为BaCO3,故答案为:BaCO3;
(2)由以上分析可知,原白色粉末中一定含有NaHCO3、BaCl2,可能含有KCl,可通过焰色反应确定是否含有KCl,
故答案为:NaHCO3、BaCl2;KCl;焰色.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,解答本题要从物质的颜色、物质之间相互作用时的实验现象等方面进行分析、判断,从而得出正确的结论,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 制成合金保护船体 | B. | 是外加电流的阴极保护法 | ||
| C. | 船体的反应:Fe-2e→Fe2+ | D. | 锌块的反应:Zn-2e→Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
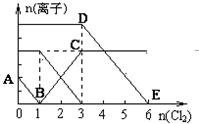 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe2+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=3 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com