
| A. | 化学电源有一次电池、二次电池和燃料电池等,一次电池只能放电,不能充电 | |
| B. | 铅蓄电池应用广泛,是一种常见的可充电电池,放电过程中电解质溶液密度逐渐增大 | |
| C. | 燃料电池具有能量利用率高、可连续使用和污染轻等优点 | |
| D. | 锂电池是一种高能电池,体积小、重量轻,单位质量电极放出的电能多 |
分析 A.一次电池不能充电,只能放电;
B.铅蓄电池放电时消耗硫酸生成硫酸铅沉淀;
C.燃料电池能量转化率高、能连续使用且污染少;
D.锂电池体积小、重量轻,单位质量能量比高.
解答 解:A.一次电池只能将化学能转化为电能,不能将电能转化为化学能,所以只能放电不能充电,故A正确;
B.铅蓄电池放电时消耗硫酸生成硫酸铅沉淀,溶液中硫酸的浓度减小,所以电解质溶液密度减小,故B错误;
C.燃料电池能量转化过程中能量散失较少,且通过不断通入燃料和氧化剂能不断产生电流,生成物污染小,故C正确;
D.Li的相对原子质量较小,其密度小,所以相同质量的金属锂的体积小,所以单位质量能量比高,故D正确;
故选B.
点评 本题考查了原电池原理,知道生活中常见电池,并会运用原电池原理分析解答,学以致用,题目难度不大,侧重于考查学生的分析能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | A原子:1s22s22p63s23p63d10 | B. | B2-:1s22s22p6 | ||
| C. | C2+:1s22s22p6 | D. | D原子:1s22s22p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 溶液中含有NH4+ |
| B | 将浓硝酸滴入碳酸钠溶液中,然后将生成的气体直接通入硅酸钠溶液中,溶液变浑浊. | 酸性:硝酸>碳酸>硅酸 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,溶液变成蓝色 | 氧化性:I2>Cl2 |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
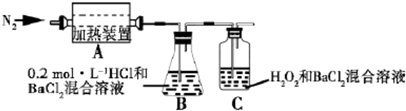
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
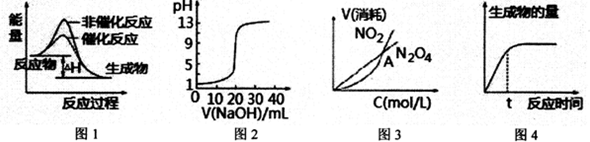
| A. | 图l表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1 000mol•L-1 CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
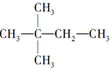 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- Cl- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应从产物结果可以得出还原性顺序:Fe2+>Br- | |
| C. | 第③组反应中生成1mol Cl2,转移电子数为2NA | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com