
| A. | 使用有少量蒸馏水的容量瓶配制溶液 | |
| B. | NaOH溶解后未冷却到室温即转移至容量瓶 | |
| C. | 移液后烧杯未用蒸馏水洗涤 | |
| D. | 定容时俯视液面 |
分析 分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏小或者使V偏大的操作都能够使溶液浓度偏低,反之使溶液浓度偏高,据此解答.
解答 解:A.使用有少量蒸馏水的容量瓶配制溶液,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故A不选;
B.NaOH溶解后未冷却到室温即转移至容量瓶,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故B不选;
C.移液后烧杯未用蒸馏水洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C选;
D.定容时俯视液面,导致溶液体积偏小,溶液浓度偏高,故D不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制误差分析,明确配制原理,准确判断操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
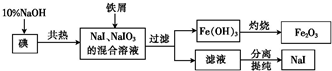
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀 | 该溶液一定含SO42- |
| B | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| C | 某溶液加入盐酸产生使石灰水变浑浊的无色无味气体 | 该溶液肯定含HCO3-、CO32-中的一种或二种 |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH;前者pH比后者的大; | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1904年,道尔顿提出了一个被称为“葡萄干面包式”的原子结构模型 | |
| B. | 在化学反应过程中,原子最外层电子数不发生变化,但原子核可能会发生变化 | |
| C. | 在活泼金属与活泼非金属的反应中,金属元素的原子得到电子,表现为负化合价 | |
| D. | 原子不带电,原子的质量主要集中在原子核上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4与C4H10互为同系物 | |
| B. | C5H12有三种同分异构体 | |
| C. | 乙烯、乙醇和乙酸都可以使高锰酸钾溶液褪色 | |
| D. | 苯分子中的碳碳键是介于单键和双键之间的独特的键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com