
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。

(1)六 ⅣA 弱
(2)PbO4+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
(3)PbO+ClO-===PbO2+Cl-
Pb2++2H2O-2e-===PbO2↓+4H+
石墨上包上铜镀层 Pb2++2e-===Pb↓ 不能有效利用Pb2+
(4)根据PbO2 PbOx+
PbOx+ O2↑,有
O2↑,有 ×32=239×4.0%
×32=239×4.0%
x=2- =1.4。
=1.4。
根据mPbO2·nPbO,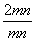 =1.4,
=1.4, =
= =
= 。
。
[解析] (1)由碳位于第二周期ⅣA族结合信息推出铅的位置;又由同主族元素性质的递变规律判断酸性;(2)PbO2与浓盐酸反应得到黄绿色的氯气,联想实验室制氯气写出化学方程式。(3)依题给信息知,反应物PbO与次氯酸钠反应,生成PbO2,由于Pb化合价升高,故另一生成物为Cl化合价降低得到的Cl-;阳极发生氧化反应,即Pb2+失去电子被氧化生成PbO2,同时考虑盐溶液水解得到的强酸性环境;阴极发生还原反应,即氧化性强的Cu2+得到电子生成铜;若电解液中不加入Cu(NO3)2,阴极发生的则是Pb2+得电子变为Pb,这样就不能有效利用Pb2+。(4)根据题意PbO2在加热过程中发生反应PbO2 PbOx+
PbOx+ O2↑,减少的质量是氧气的质量,再利用质量关系计算。
O2↑,减少的质量是氧气的质量,再利用质量关系计算。


科目:高中化学 来源: 题型:
⑴ 请写出烃(CxHy)在足量的氧气中充分燃烧的化学方程式:
。
用①甲烷,②乙烷,③丙烷,④丁烷4种烷烃,回答下列问题:
⑵ 相同状况下,等体积的上述气态烃,消耗氧气最多的是 (填物质的序号,下同)
⑶ 等质量的上述气态烃,充分燃烧时,消耗氧气最多的是 。
⑷ 在120℃ 1.01×105Pa条件下,某气态烃与足量的氧气完全反应后,测得反应前后气体的体积没有发生改变,则该烃为 。
⑸ 10mL某气态烃,在50mL氧气中充分燃烧,得到液态水,以及体积为35mL的混合气(所有气体体积均在同温同压下测定),该气态烃是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程能量变化如图所示,下列说法正确的是( )

A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,可改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |

(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。


(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。

查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MHNi电池)。下列有关说法不正确的是( )

A.放电时正极反应为NiOOH+H2O+e-―→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为MH+OH-―→H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
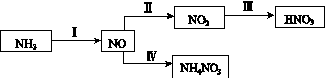
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_________________________。
(2)Ⅱ中,2NO(g)+O2(g)  2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

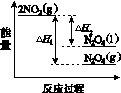

A B C
②N2O4与O2、H2O化合的化学方程式是________________________________________。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是________,说明理由:________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是


A B C D
查看答案和解析>>
科目:高中化学 来源: 题型:
在甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小顺序是 ( )
A.甲<乙<丙<丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com