
| A. | 氯丁烷 | B. | 苯 | C. | 硝基苯 | D. | 甘油 |
科目:高中化学 来源: 题型:解答题
| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
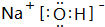 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
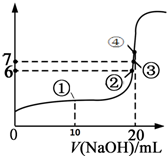 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA的浓度(mol/L) | NaOH的浓度(mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | PH=a |
| 乙 | C1 | 0.2 | PH=7 |
| 丙 | 0.1 | 0.1 | PH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
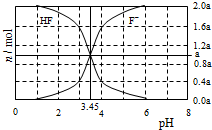 25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是
25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是| A. | pH=3时,溶液中:c(Na+)<c(F一) | |
| B. | c(F一)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol•L-1 | |
| D. | pH=3.45时,NaOH溶液恰好与HF完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
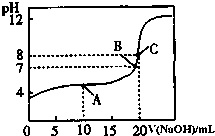 室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);
室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com