
 ČÜŅŗÖŠµÄ»Æѧ·“Ó¦“󶹏ĒĄė×Ó·“Ó¦£®øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£®
ČÜŅŗÖŠµÄ»Æѧ·“Ó¦“󶹏ĒĄė×Ó·“Ó¦£®øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£®·ÖĪö £Ø1£©“ÓĢ¼ĖįÄĘĖ®½ā½Ē¶Č¼°³Įµķ×Ŗ»Æ½Ē¶Čæ¼ĀĒ£»
£Ø2£©øł¾ŻµēĄė·½³ĢŹ½NaHSO4=Na++H++SO42-·ÖĪö£»
£Ø3£©Ļ”ŹĶ»į“Ł½ųČõµē½āÖŹµÄµēĄė£¬ČōĻ”ŹĶŗópHĻąµČ£¬ŌņĻ”ŹĶŗó°±Ė®Ģå»ż½Ļ“ó£»
£Ø4£©pH=6µÄCH3COOHÓėCH3COONaµÄ»ģŗĻČÜŅŗÖŠµÄĒāŃõøłĄė×ÓŹĒĖ®µÄµēĄėµÄ£¬øł¾ŻKw¼ĘĖćĖ®µēĄėµÄc£ØOH-£©£»
£Ø5£©ÕŅ³ö¼øøö¹Ų¼üµć£¬ĘšŹ¼µć£¬Ē”ŗĆ·“Ó¦µć¼°¼ī¹żĮæµÄµć£¬°ŃµćĮ¬³ÉĘ½»¬ĒśĻß¼“æÉ£®
½ā“š ½ā£ŗ£Ø1£©Ģ¼ĖįÄĘĖ®½āĻŌ¼īŠŌ£¬¹Ź²»ĄūÓŚ×÷ĪļÉś³¤£¬Ė®½āµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗNa2CO3+H2O?NaHCO3+NaOH£»
¼ÓČėŹÆøą£¬»įŗĶĢ¼ĖįÄĘ·“Ӧɜ³ÉĢ¼ĖįøĘ³Įµķ£¬½µµĶĮĖĢ¼ĖįøłĄė×ÓÅØ¶Č£¬ĖłŅŌĘäĶĮČĄ¼īŠŌ½µµĶ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗNa2CO3+CaSO4ØTCaCO3+Na2SO4£¬
¹Ź“š°øĪŖ£ŗNa2CO3+H2O?NaHCO3+NaOH£»Na2CO3+CaSO4ØTCaCO3+Na2SO4£»
£Ø2£©ĮņĖįĒāÄĘ“ęµēĄė·½³ĢŹ½ĪŖ£ŗNaHSO4=Na++H++SO42-£¬µēĄė³öH+£¬Ź¹ČÜŅŗĻŌĖįŠŌ£¬ŅÖÖĘĖ®µÄµēĄė£¬
¹Ź“š°øĪŖ£ŗÄęĻņ£»Ėį£»
£Ø3£©Ļ”ŹĶ»į“Ł½ųČõµē½āÖŹµÄµēĄė£¬¹ŹČōČ”pH”¢Ģå»ż¾łĻąµČµÄNaOHŗĶ°±Ė®·Ö±š¼ÓĖ®Ļ”ŹĶm±¶”¢nĻ”ŹĶŗópHČŌĻąµČ£¬Ōņ°±Ė®Ļ”ŹĶ±¶Źż“ó£¬
¹Ź“š°øĪŖ£ŗ£¼£»
£Ø4£©pH=6µÄCH3COOHÓėCH3COONaµÄ»ģŗĻČÜŅŗÖŠ£¬“×ĖįµÄµēĄė³Ģ¶Č“óÓŚ“×ĖįøłĄė×ÓµÄĖ®½ā³Ģ¶Č£¬ŌņČÜŅŗ³ŹĖįŠŌ£¬øĆ»ģŗĻŅŗÖŠµÄĒāŃõøłĄė×ÓŹĒĖ®µÄµēĄėµÄ£¬ŌņĖ®µēĄė³öµÄc£ØOH-£©=$\frac{{K}_{w}}{c£Ø{H}^{+}£©}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=10-8mol/L£¬
¹Ź“š°øĪŖ£ŗ1”Į10-8mol/L£»
£Ø5£©µ±ĒāŃõ»ÆÄĘĢå»żĪŖ0Ź±£¬ČÜŅŗpHĪŖ1£¬µ±¶žÕßĒ”ŗĆ·“Ó¦Ź±£¬ĻūŗÄĒāŃõ»ÆÄĘČÜŅŗĢå»żĪŖ20mL£¬“ĖŹ±ČÜŅŗµÄpH=7£¬Čō¼ī¹żĮ棬ŌņČÜŅŗpHŌö“ó£¬×ī“ó²»»į“óÓŚ¼īµÄpH£Ø13£©£¬ÓÉ“Ė×÷³öµĪ¶ØĒśĻߏ¾ŅāĶ¼ĪŖ£ŗ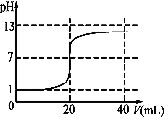 £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²éĮĖŃĪĄąĖ®½ā”¢Ė®µÄµēĄė”¢Čõµē½āÖŹµÄµēĄėĘ½ŗā”¢ÖŠŗĶµĪ¶ØµČÖŖŹ¶µć£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕŃĪµÄĖ®½āŌĄķ”¢Čõµē½āÖŹµÄµēĄėĘ½ŗā¼°ĘäÓ°Ļģ£¬£Ø5£©ĪŖŅדķµć£¬×¢ŅāÕĘĪÕÖŠŗĶµĪ¶ØŌĄķ£¬ŹŌĢāÅąŃųĮĖѧɜµÄ»ÆѧŹµŃéÄÜĮ¦£®


 Š”ѧæĪĢĆ×÷ŅµĻµĮŠ“š°ø
Š”ѧæĪĢĆ×÷ŅµĻµĮŠ“š°ø ½š²©ŹæŅ»µćČ«ĶØĻµĮŠ“š°ø
½š²©ŹæŅ»µćČ«ĶØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
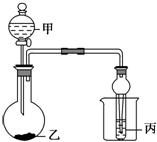 ĄūÓĆĶ¼ĖłŹ¾×°ÖĆ½ųŠŠĻĀĮŠŹµŃ飬ÄܹŪ²ģµ½ĻąÓ¦ĻÖĻó²¢µĆ³öĻąÓ¦ŹµŃé½įĀŪµÄŹĒ£Ø””””£©
ĄūÓĆĶ¼ĖłŹ¾×°ÖĆ½ųŠŠĻĀĮŠŹµŃ飬ÄܹŪ²ģµ½ĻąÓ¦ĻÖĻó²¢µĆ³öĻąÓ¦ŹµŃé½įĀŪµÄŹĒ£Ø””””£©| Ń”Ļī | ¼× | ŅŅ | ±ū | ŹµŃéĻÖĻó | ŹµŃé½įĀŪ |
| A | ÅØŃĪĖį | ŹÆ»ŅŹÆ | NaAlO2ČÜŅŗ | ŅŅÖŠÓŠĪŽÉ«ĘųÅŻ£¬±ūÖŠĻČ³öĻÖ³ĮµķŗóĻūŹ§ | ĒāŃõ»ÆĀĮČÜÓŚĢ¼Ėį |
| B | ÅØĮņĖį | ÕįĢĒ | äåĖ® | ŅŅÖŠÕįĢĒ±äŗŚÉ«”¢±ūÖŠäåĖ®ĶŹÉ« | ÅØĮņĖį¾ßÓŠĶŃĖ®ŠŌ”¢Ńõ»ÆŠŌ |
| C | Ļ”ŃĪĖį | Na2SO3 | Ba£ØNO3£©2ČÜŅŗ | ŅŅÖŠÓŠĪŽÉ«ĘųÅŻ£¬±ūÖŠ³öĻÖ°×É«³Įµķ | SO2ÓėæÉČÜŠŌ±µŃĪ¾łæÉÉś³É°×É«³Įµķ |
| D | ÅØĻõĖį | Na2CO3 | Na2SiO3ČÜŅŗ | ŅŅÖŠÓŠĪŽÉ«ĘųÅŻ£¬±ūÖŠ³öĻÖ°×É«³Įµķ | ĖįŠŌ£ŗĻõĖį£¾Ģ¼Ėį£¾¹čĖį |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ±ąŗÅ | »Æѧ·“Ó¦ | Ąė×Ó·½³ĢŹ½ | ĘĄ¼Ū |
| A | CuŗĶAgNO3ČÜŅŗ·“Ó¦ | Cu+Ag+ØTCu2++Ag | ÕżČ· |
| B | Ńõ»ÆĀĮÓėNaOHČÜŅŗ·“Ó¦ | 2Al3++3O2-+2OH-ØT2AlO2-+H2O | “ķĪó£¬Al2O3²»Ó¦Š“³ÉĄė×ÓŠĪŹ½ |
| C | FeŗĶĻ”ĮņĖį·“Ó¦ | 2Fe+6H+ØT2Fe3++3H2”ü | ÕżČ· |
| D | ÄĘÓėĮņĖįĶČÜŅŗ·“Ó¦ | 2Na+Cu2+ØTCu+2Na+ | “ķĪó£¬CuSO4²»Ó¦Š“³ÉĄė×ÓŠĪŹ½ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
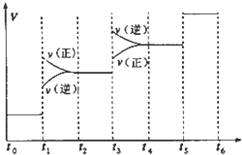 ĒāĘųŹĒŗĻ³É°±µÄÖŲŅŖŌĮĻ£¬ŗĻ³É°±·“Ó¦µÄČČ»Æ·½³ĢŹ½ČēĻĀ£ŗ
ĒāĘųŹĒŗĻ³É°±µÄÖŲŅŖŌĮĻ£¬ŗĻ³É°±·“Ó¦µÄČČ»Æ·½³ĢŹ½ČēĻĀ£ŗ| A£® | Ķ¼ÖŠt1Ź±ŅżĘšĘ½ŗāŅĘ¶ÆµÄĢõ¼žæÉÄÜŹĒÉżøßĪĀ¶Č | |
| B£® | ±ķŹ¾Ę½ŗā»ģŗĻĪļÖŠNH3µÄŗ¬Įæ×īøßµÄŅ»¶ĪŹ±¼äŹĒt5”«t6 | |
| C£® | ĪĀ¶ČĪŖT”ꏱ£¬½«2amolH2ŗĶamolN2·ÅČė0.5LĆܱÕČŻĘ÷ÖŠ£¬³ä·Ö·“Ó¦ŗó²āµĆN2µÄ×Ŗ»ÆĀŹĪŖ50%£®Ōņ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ$\frac{16}{{a}_{2}}$ | |
| D£® | ŌŚt2”«t3Ź±¼ä¶Ī£¬±£³ÖČŻĘ÷Ģå»ż²»±ä£¬³äČėŅ»¶ØĮæµÄ¶čŠŌĘųĢ壬N2µÄÅØ¶Č²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
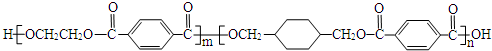
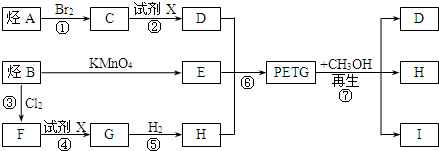
 £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
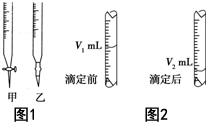 ĻÖÓĆĪļÖŹµÄĮæÅضČĪŖa mol•L-1µÄ±ź×¼NaOHČÜŅŗČ„µĪ¶ØV mLŃĪĖįµÄĪļÖŹµÄĮæÅØ¶Č£¬ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ
ĻÖÓĆĪļÖŹµÄĮæÅضČĪŖa mol•L-1µÄ±ź×¼NaOHČÜŅŗČ„µĪ¶ØV mLŃĪĖįµÄĪļÖŹµÄĮæÅØ¶Č£¬ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
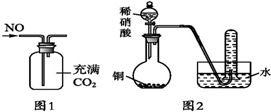
| A£® | Ęū³µĪ²ĘųÖŠÓŠNOx£¬Ö÷ŅŖŹĒĘū³µ“ņ»šŹ±µŖĘųŗĶŃõĘų·“Ó¦ŅżĘšµÄ | |
| B£® | æÉŅŌÓĆĶ¼1ĖłŹ¾×°ÖĆŹÕ¼Æµ½øÉŌļµÄNOĘųĢå | |
| C£® | øł¾ŻĶ¼2×°ÖĆŹÕ¼Æµ½µÄĘųĢåĪŖĪŽÉ«Äܹ»ŃéÖ¤ĶŗĶĻ”ĻõĖį·“Ó¦µÄ²śĪļÖŠĘųĢ¬ĪļÖŹÖ»ÓŠNO | |
| D£® | æÉŅŌÓĆŹŖČóµÄµķ·Ūµā»Æ¼ŲŹŌÖ½¼ų±šŗģ×ŲÉ«ĘųĢåNO2ŗĶäåÕōĘų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| 25”ꏱ | pHÖµ |
| ±„ŗĶH2SČÜŅŗ | 3.9 |
| SnS³ĮµķĶźČ« | 1.6 |
| FeSæŖŹ¼³Įµķ | 3.0 |
| FeS³ĮµķĶźČ« | 5.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
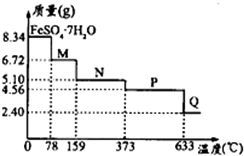
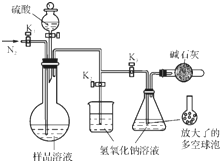 Ģ¼ĖįÄĘ-¹żŃõ»ÆĒā¼ÓŗĻĪļ£ØaNa2CO3•bH2O2£©¾ßÓŠĘÆ°×”¢É±¾ś×÷ÓĆ£®ŹµŃéŹŅÓĆ”°“¼Īö·Ø”±ÖʱøøĆĪļÖŹµÄŹµŃé²½ÖčČēĻĀ£ŗ
Ģ¼ĖįÄĘ-¹żŃõ»ÆĒā¼ÓŗĻĪļ£ØaNa2CO3•bH2O2£©¾ßÓŠĘÆ°×”¢É±¾ś×÷ÓĆ£®ŹµŃéŹŅÓĆ”°“¼Īö·Ø”±ÖʱøøĆĪļÖŹµÄŹµŃé²½ÖčČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com