
| A. | Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| B. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
分析 A.反应生成碳酸氢钙和HClO;
B.电子、电荷不守恒;
C.反应生成的HClO在离子反应中保留化学式;
D.反应生成碳酸钠和水.
解答 解:A.Ca(ClO)2溶液中通入过量的CO2的离子反应为ClO-+CO2+H2O=HCO3-+HClO,故A错误;
B.钠和冷水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.氯气和水反应的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.NaHCO3溶液与NaOH溶液反应的离子反应为OH-+HCO3-=CO32-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质和电子、电荷守恒,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:多选题
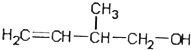 ,下列有关该物质叙述正确的是( )
,下列有关该物质叙述正确的是( )| A. | 不能与金属钠发生反应 | |
| B. | 不能使酸性高锰酸钾溶液褪色 | |
| C. | 在浓硫酸催化下.能与乙酸发生反应 | |
| D. | 常温下能与溴的四氯化碳溶液发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

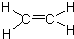 ,C的名称为乙醛
,C的名称为乙醛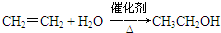 ;反应类型是加成反应;
;反应类型是加成反应;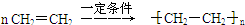 ;反应类型是加聚反应.
;反应类型是加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
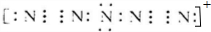 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
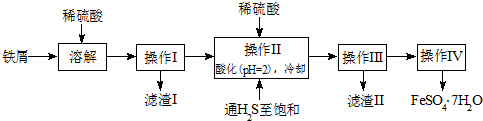
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.20 | 21.40 |
| 2 | 0.00 | 21.00 |
| 3 | 1.60 | 26.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
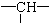 ,其余为氯原子.则氯原子的个数为( )
,其余为氯原子.则氯原子的个数为( )| A. | 2y+3x-x | B. | z+2-x | C. | 2y+z-x | D. | z+2y+2-x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
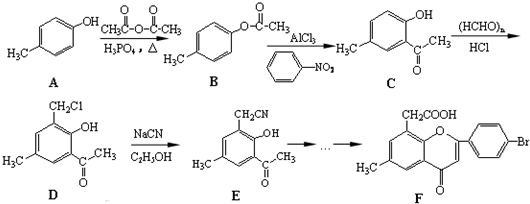
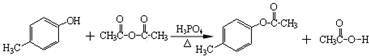 .
.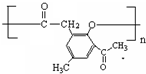 .
.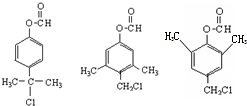 .
.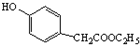 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: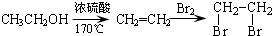
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com