
磁性材料Fe2O3可由FeSO4热分解制得,同时产生二种非金属氧化物。试根据反应方程式,判断生成的氧化产物和还原产物的物质的量之比是_____( )
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
| △H2+△H2-△H3 |
| 3 |
| △H2+△H2-△H3 |
| 3 |
| c(H2O) |
| c(H2) |
| c(H2O) |
| c(H2) |
| 实验 编号 |
催化剂 | 反应时间和m(O2)/g | |||||
| 10s | 20s | 30s | 40s | 50s | 60s | ||
| 1 | α-Fe2O3 | 0.055 | 0.215 | 0.290 | 0.310 | 0.320 | 0.320 |
| 2 | γ-Fe2O3 | 0.053 | 0.220 | 0.291 | 0.310 | 0.320 | 0.320 |
| 3 | MnO2 | 0.065 | 0.270 | 0.300 | 0.320 | 0.320 | 0.320 |
查看答案和解析>>
科目:高中化学 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:计算题
(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: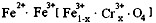 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
磁性材料Fe2O3可由FeSO4热分解制得,同时产生二种非金属氧化物。试根据反应方程式,判断生成的氧化产物和还原产物的物质的量之比是_____( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com