
分析 (1)根据题干信息可知反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,根据原子守恒书写化学反应方程式,根据方程式可知3molK2MnO4参加反应生成2molKMnO4、1molMnO2,据此判断氧化剂与还原剂的质量之比;原电池的正极上发生得电子的还原反应;
(2)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b,据此计算回答;
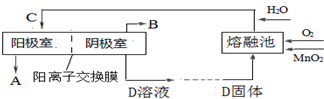
(3)根据信息:软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4来书写方程式;电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子;
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应,(NH4)2S2O8(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化.
解答 解:(1)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;锂离子有机高聚物、锂及MnO2构成原电池,正极上发生得电子的还原反应,电极反应式为:MnO2+e-+Li+=LiMnO2,
故答案为:1:2;MnO2+e-+Li+=LiMnO2;
(2)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl2的体积为0.6mol×22.4L/mol=13.44L,
故答案为:13.44;
(3)根据信息:软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4来书写方程式为:2MnO2+4KOH+O2$\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,iD是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-═2MnO4-,K+由阳离子交换膜左侧向右侧迁移,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;\;△\;\;}}{\;}$2K2MnO4+2H2O;KOH;MnO42--e-=MnO4-;K+由阳离子交换膜左侧向右侧迁移;
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,(NH4)2S2O8(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K2SO4溶液.
故答案为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;饱和K2SO4溶液.
点评 本题综合考查电解池的工作原理,方程式的书写以及电子守恒的计算知识,侧重于氧化还原反应知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| 实验 | 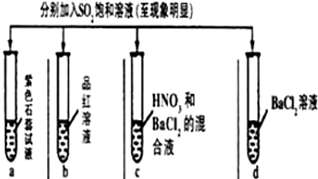 | ||||
| 记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会前期,处理废水时加入明矾可作为混凝剂可以为饮用水消毒 | |
| B. | 世博会期间,用二氧化硅制造的太阳能电池,节能减排 | |
| C. | 世博会中国馆--“东方之冠”使用的钢筋混凝土属于有机高分子化合物 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | 40mLlmol/LCH3COONa溶液与20mLlmol/LHCl溶液混合后溶液呈酸性,所得溶液中:c (CH3COO-)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍 己知:Ksp[Cd(0H)2]=7.2×10-15,Ksp[Co(0H)2]=1.8×10-15 | |
| D. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com