
【题目】(1)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:

①该反应在_________min时达到化学平衡状态。
②该反应的化学方程式是______________________。
③从开始到2min,Z的平均反应速率是________________________。
(2)某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:

通入甲醇的电极是_____(填“正”或“负”)极,反应时该电极附近的现象是_____________________________,溶液中K+向____(填“正”或“负”)极移动:写出正极反应式:_______________;若电池工作过程中通过2mol电子,则理论上消耗O2__L(标准状况)。
【答案】 2 3X+Y![]() 2Z 0.05mol·(L-1·min-1) < b a b Al-3e-=Al3+ 负 【答题空10】溶液红色变浅(答褪色不得分) 正 O2+4e-+2H2O=4OH- 11.2L
2Z 0.05mol·(L-1·min-1) < b a b Al-3e-=Al3+ 负 【答题空10】溶液红色变浅(答褪色不得分) 正 O2+4e-+2H2O=4OH- 11.2L
【解析】(1)①可逆反应达到平衡状态时,各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,根据图知,当2min时各物质的物质的量不变,则此时该反应达到平衡状态,故答案为:2;
②同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图知,该反应中参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,则X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,则该反应方程式为3X+Y![]() 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y![]() 2Z;
2Z;
③v(Z)=![]() =
=![]() =0.05mol/(L.min),故答案为:0.05mol/(L.min);
=0.05mol/(L.min),故答案为:0.05mol/(L.min);
(2)原电池中活泼性强的为负极,正极上溶液中的阳离子得电子,a极上有红色金属析出,则a为正极,b为负极。
①若a、b是两种活动性不同的金属,a为正极,b为负极,则活动性a<b;故答案为:<;
②放电时,电子从负极流向正极,则电路中的电子从b经导线流向 a;故答案为:b;a;
③溶液中阴离子向负极移动,所以溶液中的SO42-向 b移动;故答案为:b;
④若两电极分别是Al和C,Al为负极,负极上铝失电子生成铝离子,则负极的电极反应式为Al-3e-=Al3+;故答案为:Al-3e-=Al3+;
(3)通入甲醇的电极是负极,反应时该电极反应:CH3OH+8OH--6e-=CO32-+6H2O,故溶液红色变浅;该燃料电池工作时,阳离子向正极移动,氧气在碱性电解质溶液中得电子,所以电池正极的电极反应式为:O2+2H2O+4e-=4OH-,电池工作过程中通过2mol电子,则理论上消耗O2的体积=![]() ×22.4L/mol=11.2L,故答案为:负;溶液红色变浅;正;O2+2H2O+4e-=4OH-;11.2L。
×22.4L/mol=11.2L,故答案为:负;溶液红色变浅;正;O2+2H2O+4e-=4OH-;11.2L。


科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
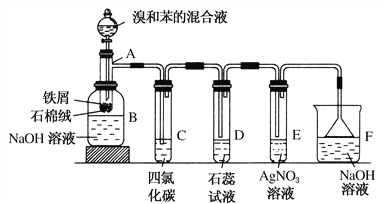
填写下列空白:
①试管A中的反应方程式为_____________________________________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D和E两试管,看到的现象为:________________________________。
写出E中反应的离子方程式__________________________________________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是___________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 2C(g)+D(g)在四种不同条件下的反应速率分别如下。则该反应在不同条件下反应速率最快的是
2C(g)+D(g)在四种不同条件下的反应速率分别如下。则该反应在不同条件下反应速率最快的是
A. v(A)=0.5 mol·L-l·min-l B. v(B)=0.6 mol·L-l·min-l
C. v(C)=0.35 mol·L-l·min-l D. v(D)=0.4 mol·L-l·min-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2 ![]() 2CO2+3H2O。下列说法不正确的是
2CO2+3H2O。下列说法不正确的是
A.C2H5OH在电池的负极上参加反应 B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极 D.电池正极得电子的物质是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式: . 每2molNa2O2参加反应,转移电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是________________。
(2)吸收塔中反应的离子方程式是___________。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______(写化学式)。
(2)加入试剂②后反应的离子方程式是_______________。
(3)步骤①包括加热、蒸发、冷却、结晶、____________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl26H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl26H2O在523℃以上分解的化学方程式是___________。
(2)现用1molMgCl26H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水_______g(精确到0.1),该盐酸中溶质的物质的量浓度是_________mol/L(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
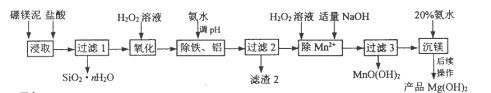
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;
过滤3所得滤渣中含有MnO(OH)2和__________。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。
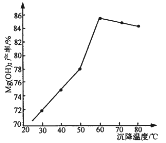
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com