
【题目】H2(g)和I2(g)、H2(g)和I2(s)以及HI(g)的能量高低如图所示,下列判断错误的是( )
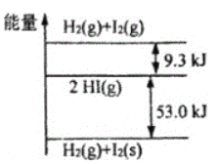
A.1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量
B.I2(g)→I2(s)+QkJ(Q>0)
C.H2(g)+I2(g)→2HI(g)+9.3kJ
D.H2(g)+I2(s)→2HI(g)+53.0kJ
【答案】D
【解析】
A.由能量高低图分析可知,2molHI(g)→1molH2(g)和1molI2(g)需要吸收9.3kJ的能量,故1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量,A选项正确;
B.由能量高低图可知,I2(g)→I2(s)放出能量,即I2(g)→I2(s)+QkJ(Q>0),B选项正确;
C.根据能量高低图分析可知,H2(g)+I2(g)→2HI(g)放出9.3kJ的能量,故H2(g)+I2(g)→2HI(g)+9.3kJ,C选项正确;
D.根据能量高低图分析可知,H2(g)+I2(s)→2HI(g)吸收53.0kJ的能量,故H2(g)+I2(s)→2HI(g)-57.3kJ,D选项错误;
答案选D。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
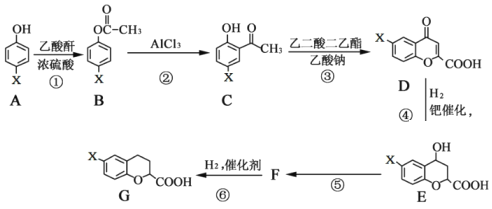
已知:乙酸酐的结构简式为 ![]() 请回答下列问题:
请回答下列问题:
(1)G物质中的含氧官能团的名称是_________________。
(2)乙二酸二乙酯的结构简式为__________________。
(3)反应A→B的化学方程式为__________________。
(4)上述⑤变化过程的反应类型为_________。
(5)有机物F的结构简式为_________。
(6)写出满足下列条件的C的同分异构体有_______种。
Ⅰ. X取代基连接在苯环上; Ⅱ. 能与NaHCO3反应生成CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为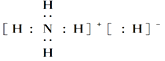
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成![]() ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
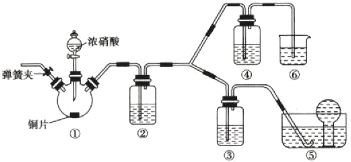
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与![]() 反应:
反应:![]() 。
。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______________________________________。
(2)滴加浓硝酸之前的操作是检查装置的气密性,加入药品,打开弹簧夹后_______________________________________。
(3)装置①中发生反应的化学方程式是____________________________________________。
(4)装置②的作用是_____________________,发生反应的化学方程式是________________________________________。
(5)该小组得出的结论所依据的实验现象是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的,他在研究海水制盐时向剩余的副产物(苦卤)中通入氯气后发现溶液的颜色变深,经过一步提取可得红棕色液体,有刺激性气味;B、C、D的核外电子层数不超过3个,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们的最外层电子数相等;D原子的最内层电子数是B原子核外电子数的2倍。回答下列问题:
(1)四种元素分别为A._____、B.____、C._____、D._____。
(2)A原子的电子排布式为________,D原子的原子结构示意图为______。
(3)写出由上述元素组成的单质和化合物相互作用生成沉淀的两个化学方程式________、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,正硅酸锂(Li4SiO4)能与CO2发生反应,对控制CO2的排放具有重要的理论意义和实用价值。完成下列填空:
(1)硅原子核外电子占有_____种能量不同的轨道;Li、C、Si的最高价氧化物中,属于原子晶体的是_____。
(2)钠元素的金属性比锂强,用原子结构的知识说明理由_____。
一定温度下,在2L的密闭容器中,Li4SiO4与CO2发生如下反应:Li4SiO4(s)+CO2(g)![]() Li2SiO3(s)+Li2CO3(s)。
Li2SiO3(s)+Li2CO3(s)。
(3)该反应的平衡常数表达式K=_____,反应20min,测得容器内固体物质的质量增加了8.8g,则0~20min内CO2的平均反应速率为_____。
(4)在T1、T2温度下,恒容容器中c(CO2)随时间t的变化关系如图所示。该反应是_____反应(选填“放热”或“吸热”)。
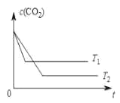
若T1温度下,达到平衡时c(CO2)为amol·L-1,保持其他条件不变,通入一定量的CO2,重新达到平衡时c(CO2)为bmol·L-1。试比较a、b的大小,并说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A. -67.7 kJ·mol-1B. -43.5 kJ·mol-1
C. +43.5 kJ·mol-1D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇具有紫丁香味,其酯类常用于香精调制。下图为松油醇的结构,以下关于它的说法正确的是
![]()
A. 分子式为C10H19O
B. 同分异构体可能属于醛类、酮类或酚类
C. 与氢气加成后的产物有4种一氯代物
D. 能发生取代、氧化、还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
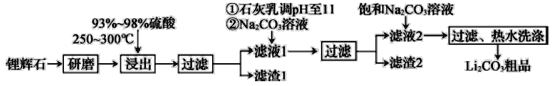
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2+H2SO4(浓)![]() Li2SO4+Al2O3·4SiO2·H2O。
Li2SO4+Al2O3·4SiO2·H2O。
③某些物质的溶解度(S)如下表所示:
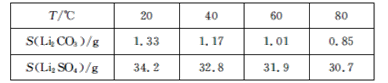
回答下列问题:
(1)从滤渣1中分离出Al2O3的流程如下所示:
![]()
写出生成沉淀的离子方程式:___。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是___(运用化学平衡原理简述)。
(3)最后一个步骤中,用“热水洗涤”的理由是___。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中电解时所用的是___(填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,LiOH溶液浓度增大的原因是___。
b中生成Li2CO3反应的化学方程式是___。
(5)磷酸亚铁锂电池总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:___。
LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com