
| ||
| ||


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、10秒内氨气的平均反应速率为0.025mol?L-1?s-1 |
| C、达平衡后,分离出少量NH3,v正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
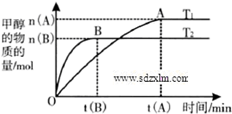 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
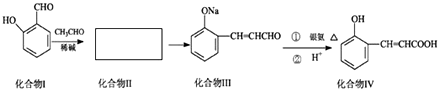
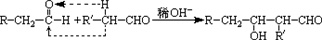
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
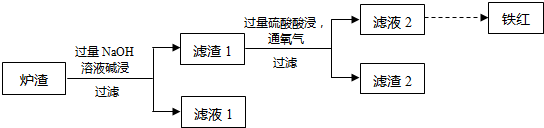
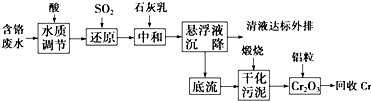 含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.
含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | N | O | F | Na | Mg | Al | P | S |
| X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 | 0.93 | 1.31 | 1.61 | 2.19 | 2.58 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com