
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
【答案】CH3COOH![]() CH3COO-+H+ c(CH3COO-)>c(Na+)> c(H+)> c(OH-) >
CH3COO-+H+ c(CH3COO-)>c(Na+)> c(H+)> c(OH-) > ![]() ac
ac
【解析】
(1)CH3COOH是弱电解质;
(2)根据电荷守恒,该缓冲溶液中c(CH3COO-)+c(OH-)= c(Na+)+c(H+),pH=4.76,c(OH-)< c(H+);
(3)Kb(CH3COO-)=![]() ;
;
(4)加少量酸、碱,缓冲溶液pH基本不变;
(5)根据平衡移动原理分析;
(1)CH3COOH是弱电解质,CH3COOH的电离方程式为CH3COOH![]() CH3COO-+H+ ;
CH3COO-+H+ ;
(2)根据电荷守恒,该缓冲溶液中c(CH3COO-)+c(OH-)= c(Na+)+c(H+),pH=4.76,c(OH-)< c(H+),离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)> c(H+)> c(OH-);
(3)Kb(CH3COO-)=![]() ,所以Ka(CH3COOH) >Kb(CH3COO-);
,所以Ka(CH3COOH) >Kb(CH3COO-);
(4)加少量酸、碱,缓冲溶液pH基本不变,用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液pH=4.76,所以c(H+)=![]() mol/L;
mol/L;
(5)a. 缓冲体系中存在H2CO3- HCO3-,代谢产生的![]() 被HCO3-结合形成H2CO3,被血液带到肺部分解成二氧化碳和水,故a正确;
被HCO3-结合形成H2CO3,被血液带到肺部分解成二氧化碳和水,故a正确;
b.血液中的缓冲体系可抵抗少量酸、碱的影响,故b错误;
c. 代谢过程产生碱性物进入血液时,H2CO3立即与OH-作用,生成H2O和HCO3-,经肾脏调节由尿排出,故c正确。


科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
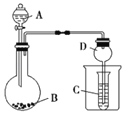
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 300 mL 2 mol/L H2SO4溶液中,SO![]() 的物质的量浓度是多少?H+的物质的量浓度是多少?溶质的质量是多少?此溶液中含 H+的物质的量是少?其中含有多少个 SO
的物质的量浓度是多少?H+的物质的量浓度是多少?溶质的质量是多少?此溶液中含 H+的物质的量是少?其中含有多少个 SO![]() ?
?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:

(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气电池的电容量大,可作为汽车的清洁能源。总反应式为:2Zn+O2+2H2O=2Zn(OH)2。示意图如图所示:
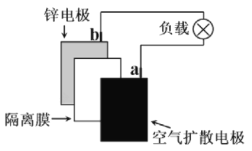
有关该电池的说法正确的是( )
A.电池可以用稀硫酸做电解质溶液
B.电池工作时,电子由a电极沿导线流向b电极
C.空气扩散电极上的电极反应:O2+2H2O+4e-=4OH-
D.阻隔空气进入锌--空气电池,电池停止工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分,其合成路线如下(部分条件已省略):
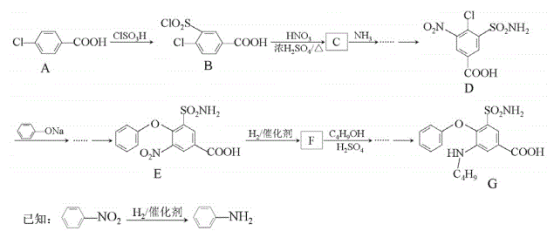
回答下列问题:
(1)A的化学名称为___。
(2)A→B的反应类型为___。
(3)F的结构简式为___。
(4)B→C的化学反应方程式为___。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为___(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)上述转化中使用的C4H9OH一般为正丁醇。以乙烯(其它无机试剂任选)为原料合成正丁醇的合成路线为___。
已知:
R1CHO+R2CH2CHO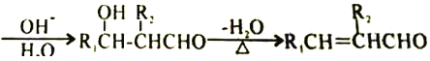
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;请配平反应的方程式KIO3+KI+H2SO4=K2SO4+I2+H2O;______________
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。滴定时,选择______________为指示剂,眼睛应该注视______________,达到滴定终点时的现象为______________,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是______________mg/kg(以含w的代数式表示)。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则所测结果会______________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学以一种工业废渣(主要成分为MgCO3和少量C、Al2O3、FeSO4等)为原料制备MgCO3·3H2O,其设计的实验流程如下:
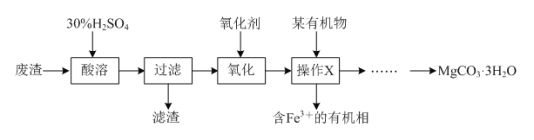
(1)质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为__________。
(2)滤渣的化学式为________;操作X的名称为__________,该操作需要的玻璃仪器是___________。
(3)已知:在下列实验中,当溶液中pH=8.5时,Mg(OH)2开始沉淀;pH=5.0时,Al(OH)3沉淀完全。请补充完整由操作X得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,________,过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com