
ҰңМвДүҰүФЪЛ®ИЬТғЦРіИЙ«µДCr2O72ӘУл»ЖЙ«µДCrO42ӘУРПВБРЖҢғв№ШПµӘғCr2O72ӘӘ«H2O![]() 2CrO42ӘӘ«2HӘ«°СЦШёхЛбәШK2Cr2O7ИЬУЪЛ®ЕдіЙµДПҰИЬТғКЗіИЙ«µДӘ®
2CrO42ӘӘ«2HӘ«°СЦШёхЛбәШK2Cr2O7ИЬУЪЛ®ЕдіЙµДПҰИЬТғКЗіИЙ«µДӘ®
ӘЁ1Ә©ПтЙПКцИЬТғЦРәУИлNaOHИЬТғӘ¬ИЬТғіК ______ Й«
ӘЁ2Ә©ПтТСәУИлNaOHИЬТғµДӘЁ1Ә©ИЬТғЦРФЩәУИл№эБүПҰБтЛбӘ¬ФтИЬТғіК ______ Й«
ӘЁ3Ә©ПтФИЬТғЦРЦрҢӨәУИлЧгБүПхЛб±µИЬТғ![]() ТСЦҒBaCrO4ОҒ»ЖЙ«іБµн
ТСЦҒBaCrO4ОҒ»ЖЙ«іБµн![]() Ә¬ФтЖҢғв ______
Ә¬ФтЖҢғв ______ ![]() МоҰ°ПтЧуТЖ¶ҮҰ±»тҰ°ПтУТТЖ¶ҮҰ±
МоҰ°ПтЧуТЖ¶ҮҰ±»тҰ°ПтУТТЖ¶ҮҰ±![]() Ә¬ИЬТғСХЙ«Ң« ______ Ә®
Ә¬ИЬТғСХЙ«Ң« ______ Ә®
Ұңөр°ёҰү»Ж іИ ПтУТТЖ¶Ү ЦрҢӨ±дОҒОЮЙ«
ҰңҢвОцҰү
ӘЁ1Ә©Cr2O72ӘӘ«H2O![]() 2CrO42ӘӘ«2HӘ«Ә¬әУИлNaOHИЬТғӘ¬ЗвАлЧУЕЁ¶ИҢµµНӘ¬ЖҢғвХэПтТЖ¶ҮӘ¬CrO42ӘµДЕЁ¶ИФцөуӘ¬ИЬТғіК»ЖЙ«Ә»
2CrO42ӘӘ«2HӘ«Ә¬әУИлNaOHИЬТғӘ¬ЗвАлЧУЕЁ¶ИҢµµНӘ¬ЖҢғвХэПтТЖ¶ҮӘ¬CrO42ӘµДЕЁ¶ИФцөуӘ¬ИЬТғіК»ЖЙ«Ә»
ӘЁ2Ә©ПтТСәУИлNaOHИЬТғµДӘЁ1Ә©ИЬТғЦРФЩәУИл№эБүПҰБтЛбӘ¬ЗвАлЧУЕЁ¶ИФцөуӘ¬ЖҢғвДжПтТЖ¶ҮӘ¬Cr2O72ӘµДЕЁ¶ИФцөуӘ¬ФтИЬТғіКіИЙ«Ә»
ӘЁ3Ә©ПтФИЬТғЦРЦрҢӨәУИлЧгБүПхЛб±µИЬТғ![]() ТСЦҒBaCrO4ОҒ»ЖЙ«іБµн
ТСЦҒBaCrO4ОҒ»ЖЙ«іБµн![]() Ә¬CrO42ӘµДЕЁ¶ИҢµµНӘ¬ФтЖҢғвПтУТТЖ¶ҮӘ¬УЙУЪЙъіЙBaCrO4іБµнӘ¬Cr2O72ӘҰұCrO42ӘµДЕЁ¶И¶әҢµµНӘ¬ИЬТғСХЙ«Ң«ЦрҢӨ±дОҒОЮЙ«ҰӘ
Ә¬CrO42ӘµДЕЁ¶ИҢµµНӘ¬ФтЖҢғвПтУТТЖ¶ҮӘ¬УЙУЪЙъіЙBaCrO4іБµнӘ¬Cr2O72ӘҰұCrO42ӘµДЕЁ¶И¶әҢµµНӘ¬ИЬТғСХЙ«Ң«ЦрҢӨ±дОҒОЮЙ«ҰӘ


 үмАЦРҰІ©Кү№®№МУлМбёЯПµБРөр°ё
үмАЦРҰІ©Кү№®№МУлМбёЯПµБРөр°ё
| Дкә¶ | ёЯЦРүОіМ | Дкә¶ | іхЦРүОіМ |
| ёЯТ» | ёЯТ»Гв·СүОіМНЖәцӘҰ | іхТ» | іхТ»Гв·СүОіМНЖәцӘҰ |
| ёЯ¶ю | ёЯ¶юГв·СүОіМНЖәцӘҰ | іх¶ю | іх¶юГв·СүОіМНЖәцӘҰ |
| ёЯИэ | ёЯИэГв·СүОіМНЖәцӘҰ | іхИэ | іхИэГв·СүОіМНЖәцӘҰ |
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰү298KК±Ә¬ФЪ20.0mL0.10molҰ¤L-1ВИЛ®ЦРµОИл0.10molҰ¤L-1µДСОЛбӘ¬ИЬТғµДpHУлЛщәУСОЛбµДМе»э№ШПµИзНәЛщКңҰӘәғЦҒ0.10molҰ¤L-1°±Л®µДµзАл¶ИОҒ1.32%Ә¬ПВБРУР№ШРрКцХэИ·µДКЗ

A. ёГµО¶Ё№эіМУ¦ёГСҰФс·УМҒЧчОҒЦёКңәБ
B. Mµг¶ФУ¦µДСОЛбМе»эОҒ20.0mL
C. Mµгө¦µДИЬТғЦРc(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. Nµгө¦µДИЬТғЦРpHӘә12
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүоСә°Жд»ҮғПОпУ¦УГ№г·ғҰӘ
(1)(оСФҒЛШ»щМ¬ФЧУғЛНвЧоНвІгµзЧУµДЧФРэЧөМ¬___ӘЁМоҰ°ПаН¬Ұ±»тҰ°Па·өҰ±Ә©ҰӘ
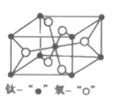
(2)ТСЦҒТ»¶ЁМхәюПВTiO2УлTiCl4Ц®әдүЙТФПа»ӨЧҒ»ҮӘғTiO2![]() TiCl4ҰӘ
TiCl4ҰӘ
ұЩTiҰұClҰұOИэЦЦФҒЛШµзёғРФУЙөуµҢРҰµДЛіРтОҒ___ҰӘ
ұЪCOCl2µД·ЦЧУ№№РНОҒ___Ә¬әьҢЗөуРҰ±ИҢПҰПClҰҒCҰҒO___ҰПC1ҰҒCҰҒClӘЁМоҰ°>Ұ±»тҰ°<Ұ±Ә©Ә¬¦ТәьғН¦РәьКэДүЦ®±ИОҒ___ҰӘ
ұЫТСЦҒКТОВПВTiCl4ОҒОЮЙ«ТЧИЬУЪТТөәµДТғМеӘ¬ФтTiCl4µДң§МеАаРНОҒ___ҰӘ
ӘЁ3Ә©ЕдғПОп[TiCl(H2O)5]Cl2Ұ¤H2OЦРӘ¬ЦРРДАлЧУµДЕдО»КэКЗ___Ә¬Пт1molёГЕдғПОпЦРәУИлЧгБүAgNO3ИЬТғӘ¬үЙТФµГµҢ___molAgClіБµнҰӘ
ӘЁ4Ә©ҢрғмКҮРНTiO2µДң§°ы(¦Б=¦В=¦Г=90o)ИзНәЛщКңӘғTiO2ң§МеЦРOФЧУµДЕдО»КэКЗ___Ә¬Ждң§°ыІОКэОҒӘғa=b=459pmӘ¬c=295pmӘ¬ёГң§МеГЬ¶ИОҒ___g/cm3ӘЁБРіцәЖЛгКҢӘ©ҰӘ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүФЪТ»¶ЁОВ¶ИПВӘ¬үЙДж·өУ¦A(g)Ә«3B(g) ![]() 2C(g)Ә¬өпµҢЖҢғвµД±кЦңКЗ
2C(g)Ә¬өпµҢЖҢғвµД±кЦңКЗ
A.CЙъіЙµДЛЩВКУлC·ЦҢвµДЛЩВКПаµИ
B.AҰұBҰұCµДЕЁ¶ИПаµИ
C.µӨО»К±әдДЪЙъіЙn molAӘ¬Н¬К±ПығД2nmol C
D.µӨО»К±әдДЪЙъіЙn molAӘ¬Н¬К±ПығД3nmol B
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүӘЁ1Ә©КµСйІвµГӘ¬5gТғМ¬әЧөә(CH3OH)ФЪСхЖшЦРід·ЦИәЙХЙъіЙ¶юСх»ҮМәЖшМеғНТғМ¬Л®К±КН·Еіц113Ә®5kJµДИИБүӘ¬КФРөіцәЧөәИәЙХµДИИ»ҮС§·ҢіМКҢ____________________________________ҰӘ
ӘЁ2Ә©әғЦҒ·өУ¦N2+3H2![]() 2NH3 ҰчH=akJ/molҰӘКФёщңЭПВ±нЦРЛщБРәьДЬКэңЭ№АЛгaµДКэЦµОҒ______ҰӘ
2NH3 ҰчH=akJ/molҰӘКФёщңЭПВ±нЦРЛщБРәьДЬКэңЭ№АЛгaµДКэЦµОҒ______ҰӘ
»ҮС§әь | H-H | N-H | NҰФN |
әьДЬkJ/mol | 436 | 391 | 945 |
ӘЁ3Ә©ТАңЭёЗЛ№¶ЁВЙүЙТФ¶ФДіР©ДСТФНЁ№эКµСйЦ±ҢУІв¶ЁµД»ҮС§·өУ¦µДмК±дҢшРРНЖЛгҰӘ
әғЦҒӘғC(sӘ¬КҮД«)+O2(g)=CO2(g) ҰчHl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) ҰчH2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) ҰчH3=-2599kJ/mol
сМНЖёЗЛ№¶ЁВЙӘ¬әЖЛг298KК±УЙC(s,КҮД«)ғНH2(g)ЙъіЙ1mol C2H2(g)·өУ¦ИИ»ҮС§·ҢіМКҢ:__________ҰӘ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүУГNA±нКң°ұ·ьәУµВВЮіӘКэµДЦµӘ¬ПВБРЛµ·ЁХэИ·µДКЗӘЁҰҰҰҰӘ©
A. ±кЧәЧөүцПВӘ¬22.4 LЗвЖшЦРғ¬УР2NAёцЦРЧУ
B. 0.1NAёцВИ»ҮЗв·ЦЧУХәУРМе»эОҒ2.24 L
C. 2үЛҢрКфёЖ±діЙёЖАлЧУК±К§ИӨµДµзЧУКэОҒ0.1NA
D. 50 mL 0.1 molҰ¤L-1H2SO4ИЬТғЦРғ¬УРH+КэОҒ0.005NA
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүДіС§ЙъУыФЪКµСйКТЦЖ±ёОЮЛ® FeCl3 ІұµГµҢё±ІъОп FeCl3 ИЬТғҰӘңІйФДЧКБПµГЦҒӘғОЮЛ® FeCl3 ФЪүХЖшЦРТЧі±ҢвӘ¬әУИИТЧЙэ»ҒҰӘИзНәКЗЛыЙиәЖµДКµСйЧ°ЦГНәӘЁәУИИә°әРіЦЧ°ЦГВФИӨӘ©
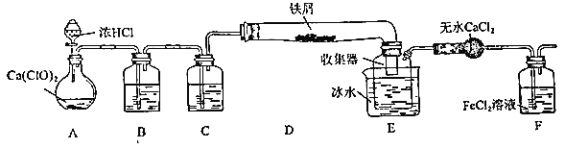
НкіЙПВБРМоүХӘғ
ӘЁ1Ә©Ч°ЦГ A КЗ Cl2 ·ұЙъЧ°ЦГӘ¬ЖдЦРµД»ҮС§·өУ¦·ҢіМКҢОҒ_____
ӘЁ2Ә©B ЦРµДИЬТғКЗ_____Ә¬C µДЧчУГКЗ_____
ӘЁ3Ә©D әУИИғуӘ¬ЙЩБүЙъіЙ FeCl3 іБ»эФЪD µДУТ¶ЛӘ¬ТҒК№іБ»эµД FeCl3 ҢшИлEӘ¬ІЩЧчКЗ______________
E ЦР±щЛ®µДЧчУГОҒ_____
ӘЁ4Ә©КµСйФ±АПК¦¶ФЙПКцЧ°ЦГМбіцБЛ 2 µгёДҢшҢЁТйӘғТ»КЗЧ°ЦГБ¬ҢУІү·Ц¶әёДіЙ±кЧәІӘБ§ҢУүЪӘ¬І»УГПрҢғБ¬ҢУәюµДФТтКЗ_____Ә»¶юКЗХвМЧЧ°ЦГ»№өжФЪТ»ёцғЬөуµДИ±ПЭӘ¬ёДҢшµД·Ң·ЁКЗ_______________
ӘЁ5Ә©Ц¤Гч FЦР FeCl2 Оө±»НкИ«Сх»ҮµД·Ң·ЁКЗ_____
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүКТОВПВӘ¬Ң«Т»¶ЁЕЁ¶ИµДТ»ФҒЛбHAИЬТғғНТ»¶ЁЕЁ¶ИµДNaOHИЬТғµИМе»э»мғПӘЁғцВФМе»э±д»ҮӘ©Ә¬КµСйКэңЭИзПВ±нӘғ
КµСй±ағЕ | ЖрКәЕЁ¶ИӘЁmol/LӘ© | ·өУ¦ғуИЬТғµДpH | |
|
| ||
ұЩ | 0.1 | 0.1 | 9 |
ұЪ |
| 0.2 | 7 |
ПВБРЕР¶ПІ»ХэИ·µДКЗӘЁ Ә©
A.КµСйұЩ·өУ¦µДИЬТғЦРӘғ![]()
B.КµСйұЩ·өУ¦µДИЬТғЦРӘғ![]()
C.КµСйұЪ·өУ¦µДИЬТғЦРӘғ![]()
D.КµСйұЪ·өУ¦µДИЬТғЦРӘғ![]()
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүіӘОВПВӘ¬Пт20mL0.1molҰ¤L-1µДHAИЬТғЦРЦрµОәУИл0.1molҰ¤L-1µДЙХәоИЬТғӘ¬ИЬТғЦРЛ®ЛщµзАлµДcЛ®ӘЁH+Ә©ЛжәУИлЙХәоИЬТғМе»эµД±д»ҮИзНәЛщКңӘ¬ПВБРЛµ·ЁХэИ·µДКЗӘЁ Ә©

A.BµгµДИЬТғЦРБӘЧУЕЁ¶ИЦ®әдөжФЪӘғc(HA)Әңc(Na+)Әңc(A-)
B.УЙНәүЙЦҒA-µДЛ®ҢвЖҢғвіӘКэKhФәОҒ1ҰБ10-9
C.CҰұEБҢµгТтОҒ¶ФЛ®µДµзАлµДТЦЦЖЧчУГғНөЩҢшЧчУГПаН¬Ә¬ЛщТФИЬТғңщіКЦРРФ
D.FµгµДИЬТғіКәоРФӘ¬БӘЧУЕЁ¶ИЦ®әдөжФЪӘғc(OH-)=c(HA)+c(A-)+c(H+)
Ійүөөр°ёғНҢвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
ғю±±КҰ»ӨБҒНшОӨ·ЁғНІ»БәРЕПұңЩ±ЁЖҢМЁ | НшЙПУРғ¦РЕПұңЩ±ЁЧЁЗш | µзРЕХ©ЖңЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРғ¦РЕПұңЩ±ЁЧЁЗш | ЙжЖуЗЦИЁңЩ±ЁЧЁЗш
ОӨ·ЁғНІ»БәРЕПұңЩ±Ёµз»°Әғ027-86699610 ңЩ±ЁУКПдӘғ58377363@163.com