
| A. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为lNA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C一H键数目一定为0.5NA | |
| C. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA个Cl- |
分析 A.一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B.不知道C2H6O结构,无法判断46gC2H6O中含有的C-H极性键数目;
C.二氧化碳与过氧化钠反应属于歧化反应,过氧化钠中-1价氧部分化合价升高,部分降低;
D.溶液体积未知.
解答 解:A.1 mol FeCl3 水解生成的Fe(OH)3胶粒数小于lNA,故A错误;
B.46g分子式为C2H6O的物质的量为1mol,若C2H6O为甲醚,1mol中含有6mol碳氢极性键,若是乙醇,含有5molC-H键,故B错误;
C.二氧化碳与过氧化钠反应属于歧化反应,1mol二氧化碳参加反应转移1mol电子,则标准状况下,11.2 L CO2 物质的量为0.5mol,与足量Na2O2反应转移的电子数为0.5NA,故C正确;
D.溶液体积未知,无法计算氯离子个数,故D错误.
故选:C.
点评 本题考查了阿伏伽德罗常数的应用和有关计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意有机物结构特点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(HCl)>c(CH3COOH) | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 | |
| D. | 用同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
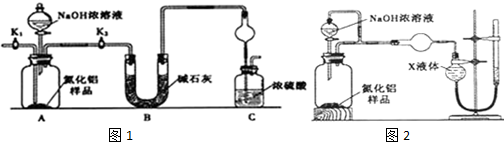
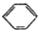
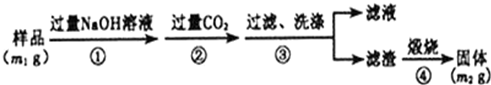
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
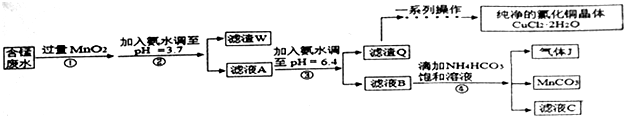
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
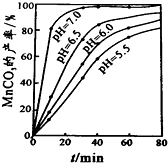
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63- | |
| B. | 使甲基橙变红的溶液:NH4+、CH3COO一、SO42+、Mg2+ | |
| C. | 某无色溶液:OH一、K+、ClO一、Ba2+ | |
| D. | 含有大量NO3-的溶液:K+、I一、NH4+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
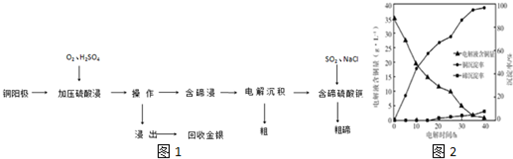
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
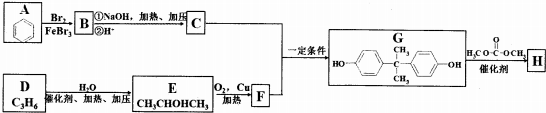
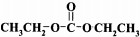 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$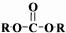 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基)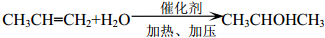 .
.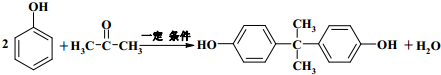 .
.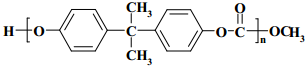 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com