

分析 (1)①根据燃烧热写出①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
依据盖斯定律,②×4-①来计算焓变;
②电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵;
(2)①根据v=$\frac{△c}{△t}$结合图象计算CH3OH的速率,再根据速率之比等于系数之比计算CO的化学反应速率;根据平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$及各组分的浓度计算出该反应的平衡常数;
②反应速率加快,根据升温或者使用催化剂可以使反应速率加快分析;
(3)①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;根据溶液呈中性pH=7c(H+)=c(OH-)结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)进行解答;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=bmol/L,以此计算.
解答 解:(1)①CH4、H2的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol;
则①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
依据盖斯定律,②×4-①得到:CO2 (g)+4H2(g)=CH4(g)+2H2O(l)△H=-285.8kJ•mol-1×4+890.3KJ/mol=-252.9 kJ/mol;
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9 kJ/mol;
②该电池的本质反应是合成氨反应,电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-=2NH4+,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液,
故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)①根据图象CH3OH的速率v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{10min}$=0.03mol/(L•min),又速率之比等于系数之比,所以CO的化学反应速率也为0.03mol/(L•min);又由图象可以看出平衡时氢气的物质的量为0.8mol,CO为0.4mol,CH3OH为0.6mol,所以平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$=$\frac{75}{8}$,
故答案为:0.03mol/(L•min);$\frac{75}{8}$;
②反应速率加快,而且在10分钟的时刻,达平衡状态,可能是反应受热或使用了催化剂,
故答案为:反应受热或使用了催化剂;
(3)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),溶液中的溶质为乙酸钠溶液,水的电离是微弱的,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=bmol/L,则CH3COOH的电离常数Ka=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}mol/L×bmol/L}{(a-b)mol/L}$=$\frac{1{0}^{-7}b}{a-b}$,
故答案为:$\frac{1{0}^{-7}b}{a-b}$.
点评 本题考查盖斯定律的应用、原电池原理、平衡的移动和溶液中的反应等相关知识,综合性强,比较有难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
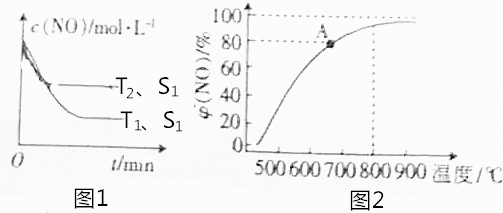
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,F
,F ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com