
【题目】氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中不属于区域3的化学反应是( ) 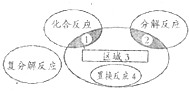
A.Br2+SO2+2H2O═H2SO4+2HBr
B.CuO+CO ![]() Cu+CO2
Cu+CO2
C.4NH3+5O2═4NO+6H2O
D.3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)一I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
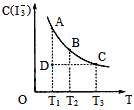
A. 反应I2(aq)+I-(aq)=I3-(aq)△H<0
B. 若温度为T1、T2反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO﹣被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出.本实验所用的仪器及导管如图1所示. 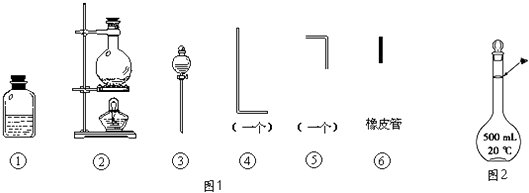
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为(填写图中编号).
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 .
(3)仪器①的橡皮塞上至少应有2个孔的原因是 .
(4)本实验需配置10molL﹣1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有(填仪器名称),定容时操作如图2,则所配溶液浓度(填“偏高”或“偏低”).
(5)实验时仪器①中ClO﹣与H2O2反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH4和CO组成的混合气体,在标准状况下的密度为1gL﹣1 , 则混合气体中CH4和CO的质量比为( )
A.1:1
B.1:2
C.2:3
D.7:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
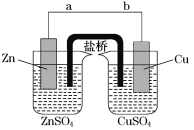
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
(1)写出肼的电子式 , 1mol N2H4中有个极性共价键.
(2)NH3与NaClO反应可以得到肼,该反应的化学方程式为 .
(3)发射火箭时,肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水.已知1.6g液态N2H4在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式: .
(4)肼﹣空气燃料电池是一种碱性电池,该电池放电时负极反应式为 .
(5)肼性质与氨气相似,易溶于水,可发生如下电离过程:Ⅰ、N2H4+H2O═N2H5++OH﹣Ⅱ、N2H5++H2O═N2H62++OH﹣
①常温下,某浓度N2H6C12溶液的pH为5,则该溶液中由水电离产生的c(OH﹣)= .
②已知在相同条件下过程I的进行程度大于N2H5+的水解程度.常温下,若0.2mol/L N2H4溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、N2H4H2O、Cl﹣、OH﹣、H+ 粒子浓度由大到小的顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有密度为1.8g/m3、质簠分数为98%的“化学纯”硫酸.
(1)取该浓硫酸1L加蒸馏水稀释至18L,稀释后硫酸的物质的量浓度为
(2)现有Na2CO3、NaHCO3组成的混合物,加热到质量不再减少为止,放出标准状况下气体2.24L,取稀释后硫酸200mL恰好与剩余的残渣完全反应,又放出标准状况下气体AL,试计算①原混合物的质量
②原混合物Na2CO3与NaHCO3物质的量之比
③A= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com