
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
| D.称量样品→加NaOH→过滤→加热→冷却→称量CuO |
科目:高中化学 来源:不详 题型:问答题
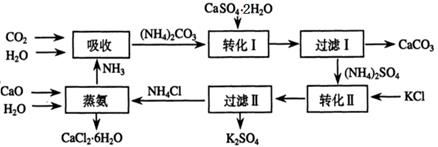
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
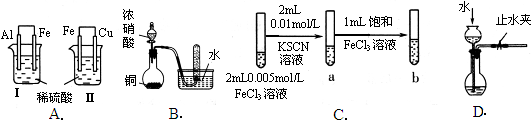
| 实验 | 实验现象 | 结论 |
| A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
| B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
| C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.观察KCl溶液没有颜色 |
| B.向FeCl3溶液中滴加适量NaOH溶液,振荡静置,过滤后所得滤液黄色消失 |
| C.向FeCl3溶液中滴加适量AgNO3溶液,振荡静置,过滤后所得滤液黄色未消失 |
| D.加水稀释后FeCl3溶液黄色变浅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
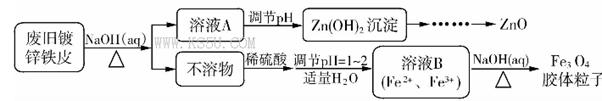
 Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
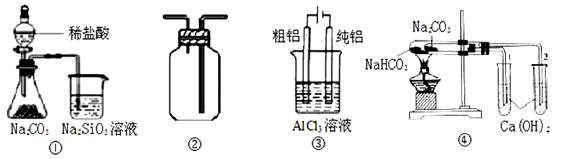
| A.用图①装置验证氯、碳、硅元素非金属性 |
| B.用图②装置能收集O2、CO2和H2 |
| C.用图③装置电解精炼铝 |
| D.用图④装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


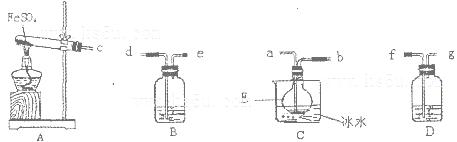
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取25 g CuSO4?5H2O溶于1 L水中 |
| B.将CuSO4?5H2O干燥去掉结晶水,取16 g溶于水制成1 L溶液 |
| C.将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D.取12.5 g CuSO4?5H2O溶于500 mL水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com