
【题目】含![]() 、
、![]() 元素的物质在生产生活中有重要的用途。回答下列问题:
元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态![]() 核外电子排布式为________。
核外电子排布式为________。
(2)![]() 分子的立体构型为________。
分子的立体构型为________。
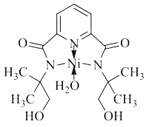
(3)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:

①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键______。
的配位键______。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________。
(5)![]() 的酸性强于
的酸性强于![]() 的原因是________,
的原因是________,![]() 的键角小于
的键角小于![]() 的原因是________。
的原因是________。
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________,Ni原子占据的空隙类型为________。已知晶胞参数分别为apm、apm、bpm和![]() ,则该品胞的密度为________
,则该品胞的密度为________![]() (设阿伏加德罗常数的值为NA)
(设阿伏加德罗常数的值为NA)

【答案】![]() 或
或![]() 三角锥形
三角锥形 ![]()
![]()
 As>Se>Ge
As>Se>Ge ![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强 砷原子电负性小于氮原子,所以其共用电子对离砷核距离较远,成键电子间的斥力较小,导致键角较小
酸性更强 砷原子电负性小于氮原子,所以其共用电子对离砷核距离较远,成键电子间的斥力较小,导致键角较小 ![]() 八面体空隙
八面体空隙 ![]()
【解析】
(1)根据构造原理,写出镍的核外电子排布式;
(2)根据价层电子对互斥理论,判断出价层电子对数,得出分子的构型;
(3)①根据N原子的成键方式,判断杂化类型;
②根据配位键的定义画出配位键;
(4)Ge,As,Se元素处于同一周期,根据同周期第一电离能的变化规律判断;
(5)比较分子中非羟基氧原子数目,从电负性角度分析;
(6) Ni位于顶点和棱心,As位于体心,计算出Ni和As的个数,得出分子式,六个镍原子围成八面体空隙,利用密度公式![]() ,上下底面是菱形,计算出面积S底=
,上下底面是菱形,计算出面积S底=![]() ,代入密度公式。
,代入密度公式。
(1)28号元素是镍,核外电子排布式为![]() ,基态
,基态![]() 失去最外层的两个电子,核外电子排布式为
失去最外层的两个电子,核外电子排布式为![]() 或
或![]() ;
;
(2)![]() 的中心原子为砷,最外层有5个电子,与三个氯原子形成三对共价键,剩余一对孤对电子,价层电子对数为4对,分子的立体构型为三角锥形;
的中心原子为砷,最外层有5个电子,与三个氯原子形成三对共价键,剩余一对孤对电子,价层电子对数为4对,分子的立体构型为三角锥形;
(3) ①氮原子形成一对双键,两对单键时,价层电子对数为3对,杂化方式为![]() ,形成三对单键的氮原子形成的σ键数为3对,孤对电子数为1对,价层电子对数为4对,杂化方式为
,形成三对单键的氮原子形成的σ键数为3对,孤对电子数为1对,价层电子对数为4对,杂化方式为![]() 杂化;
杂化;
②镍原子正上方的氮原子,有一对孤对电子,下方水分子提供孤对电子,镍原子提供空轨道,形成两对配位键,表示为 ;
;
(4)Ge,As,Se元素处于同一周期,同周期第一电离能呈现增大的趋势,As的最外层4p轨道为半充满状态,第一电离能高于Se和Ge,故第一电离能由大到小为:As>Se>Ge
(5) ![]() 分子结构中非羟基氧原子数比
分子结构中非羟基氧原子数比![]() 多,所以
多,所以![]() 的酸性强.或
的酸性强.或![]() 分子中As价态更高,导致
分子中As价态更高,导致![]() 中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故
中的O的电子向As偏移,氧氢键的极性变大,在水分子作用下,越容易电离出H+,故![]() 酸性更强;
酸性更强;
砷原子电负性小于氮原子,所以其共用电子对离砷核距离较远,成键电子间的斥力较小,导致键角较小,![]() 的键角小于
的键角小于![]() ;
;
(6) Ni位于顶点和棱心,个数为8×![]() +4×
+4×![]() =2,As位于体心,个数为2,原子个数最简比为1:1,化学式为
=2,As位于体心,个数为2,原子个数最简比为1:1,化学式为![]() ;六个镍原子围成八面体空隙;
;六个镍原子围成八面体空隙;![]() ,M=59+75=134g/mol,N=2,上下底面是菱形,计算出面积S底=
,M=59+75=134g/mol,N=2,上下底面是菱形,计算出面积S底=![]() ,代入密度公式得到
,代入密度公式得到![]() 。
。


科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8 = Li2S8)工作原理示意图如图。

下列有关该电池说法不正确的是( )
A.A 电极为该电源的负极,电极材料主要是金属锂和石墨烯
B.B 电极的反应:2Li++S8+2e = Li2S8
C.充电时,电极A与电源负极连接,作为阴极
D.为提高电池效率,该电池可选用稀硫酸作为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中加入足量的镁条,该体系
溶液中加入足量的镁条,该体系![]() 随时间变化的曲线如图所示。实验观察到
随时间变化的曲线如图所示。实验观察到![]() 点开始溶液中有白色沉淀生成,已知
点开始溶液中有白色沉淀生成,已知![]() 。下列说法错误的是( )
。下列说法错误的是( )
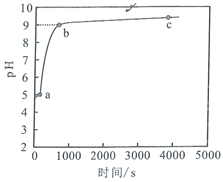
A.常温下,![]() 的水解平衡常数数量级为
的水解平衡常数数量级为![]()
B.体系中,水的电离程度大小关系为![]()
C.![]() 点时,溶液中
点时,溶液中![]()
D.![]() 点溶液中,
点溶液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向![]() 溶液中通入
溶液中通入![]() 和
和![]() ,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
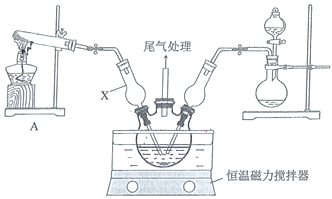
(1)仪器X的名称是________,其主要作用有导气、________。
(2)实验室利用装置A制![]() ,发生反应的化学方程式为________。
,发生反应的化学方程式为________。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是________、________、________。
(4)若体系![]() 过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
(5)反应结束后,将三颈瓶中的混合物过滤,从滤液中还可以获得的副产品是________(填化学式),经提纯得产品无水碱式氯化铜。
Ⅱ.无水碱式氯化铜组成的测定。称取产品![]() ,加硝酸溶解,并加水定容至200mL,得到待测液。
,加硝酸溶解,并加水定容至200mL,得到待测液。
(6)铜的测定:取20.00mL测液,经测定,![]() 浓为
浓为![]() 。则称取的样品中
。则称取的样品中![]() ________mol。
________mol。
(7)采用沉淀滴定法测定氯:用![]() 标准溶液滴定过量的
标准溶液滴定过量的![]() ,实验如图:
,实验如图:

①滴定时,应选用下列哪种物质作为指示剂________(填标号)。
A.![]() B.
B.![]() C.
C.![]()
②重复实验操作三次,消耗![]() 溶液的体积平均为10.00mL。则称取的样品中
溶液的体积平均为10.00mL。则称取的样品中![]() ______mol。
______mol。
(8)根据上述实验结果可推知无水碱式氯化铜的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国中草药文化源远流长,通过临床试验,从某中草药中提取的有机物具有较好的治疗癌症的作用,该有机物的结构如图所示。下列说法中错误的是( )

A.分子式为C13H12O6
B.该有机物能发生取代反应、加成反应、氧化反应
C.1mol该有机物与NaOH反应最多消耗2molNaOH
D.1mol该有机物与溴水反应最多消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题:
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为____________,该反应中Cu2O作_________(填“氧化剂”或“还原剂”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
(2)压强为p kPa时,同一体系中发生反应①和反应②,温度对二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡转化率的影响如图1所示,则ΔH1______0(填“>”或“<”,下同)、ΔH2______0。温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。
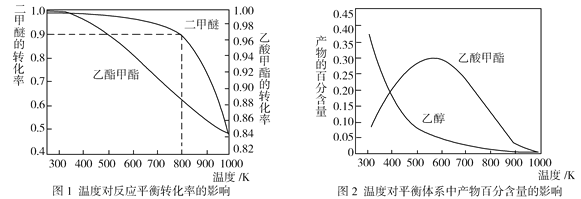
(3)若压强为p kPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3和1 mol CO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应:2NOC1+H2O=2HC1+NO↑+NO2↑。某化学兴趣小组设计如图装置用C12和NO制备NOC1。回答下列相关问题:
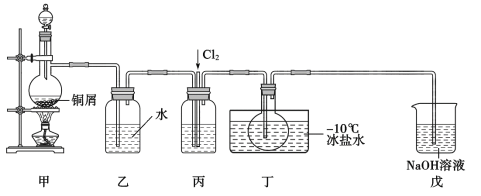
(1)甲装置发生的离子反应方程式为__,装置丙中的液体为__。
(2)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是__。
(3)装置丁中冰盐水的作用是__。
(4)经分析该套装置设计上有一处明显缺陷,改进方法是__(用文字描述)。
(5)吸收尾气时,NOCl发生反应的化学方程式为__。
(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)反应完成后,取烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL。则产物中NOCl纯度的计算式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1.2g金刚石中含有的共价键数为0.4NA
B.标准状况下,2.24 L CCl4含有个0.1 NA个CCl4分子
C.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
D.1 mol固体NaHSO4中含有阳离子的数目是2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com