
(12分) X、Y、Z、R、Q5种非金属元素的原子序数依次增大,Y、Z、R、Q4种元素位于不同周期且均没有放射性,Y、Z、R形成的单质在通常状况下状态各不相同;XY3为非极性分子,ZR3为极性分子;由Q原子能直接形成熔沸点很低的单质晶体。
(1)甲(化学式为XZ)是一种受到高度关注的耐磨涂料,可用作金属的表面保护层。甲可由XR3和ZR3在氢气中高温反应合成,合成甲的化学反应方程式为:______________________________________________________________;画出XR3分子的结构______________________,指出ZR3分子的空间构型____________________。
(2)用水处理QY2和QY4的混合物,得到气体乙和溶液丙,乙的体积为56.7 mL(标准状况,下同),其中含O2 22.7 mL,余为Q。丙中的QO3能氧化30.0mL浓度为0.100mol/L的(NH4)2Fe(SO4)2。计算混合物中QY2和QY4的物质的量之和为多少?
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
(2010?金华模拟)实验测得某同学在活动前后吸入、呼出气体中各种气体的体积百分含量如下表所示.
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省高三上学期期末考试化学试卷 题型:填空题
(选修—物质结构与性质)(12分)
X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。
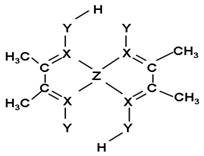
(1)Z原子的价层电子排布式为____________;XY3-离子的空间构型为__________。
(2)X单质与Y单质直接发生化合反应的化学方程式_________________________。
(3)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO_____ FeO(填“<”或“>” )。
(4)ZO晶体中Z2+的配位数为____________。
(5)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+
反应可生成鲜红色沉淀,其结构如图所示:
① 该结构中,碳碳之间的共价键类型是______(“σ键”
或“π键”);X与Z2+离子间形成的是配位键,在图
上标出配位键的电子给予的方向。
② 该结构中,Y原子与氢原子除了形成共价键外,
还可存在_______ ;
该结构中,碳原子的杂化轨道类型有_____;Y原子的杂化轨道类型为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
(选修—物质结构与性质)(12分)
X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。
(1)Z原子的价层电子排布式为____________;XY3-离子的空间构型为__________。
(2)X单质与Y单质直接发生化合反应的化学方程式_________________________。
(3)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO_____ FeO(填“<”或“>” )。
(4)ZO晶体中Z2+的配位数为____________。
(5)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+
反应可生成鲜红色沉淀,其结构如图所示:
① 该结构中,碳碳之间的共价键类型是______(“σ键”
或“π键”);X与Z2+离子间形成的是配位键,在图
上标出配位键的电子给予的方向。
② 该结构中,Y原子与氢原子除了形成共价键外,
还可存在_______ ;
该结构中,碳原子的杂化轨道类型有_____;Y原子的杂化轨道类型为_____。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江省牡丹江一中高三上学期期末考试化学试卷 题型:填空题
(选修—物质结构与性质)(12分)
X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。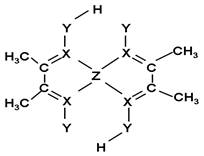
(1)Z原子的价层电子排布式为____________;XY3-离子的空间构型为__________。
(2)X单质与Y单质直接发生化合反应的化学方程式_________________________。
(3)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO_____ FeO(填“<”或“>” )。
(4)ZO晶体中Z2+的配位数为____________。
(5)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+
反应可生成鲜红色沉淀,其结构如图所示:
该结构中,碳碳之间的共价键类型是______(“σ键”
或“π键”);X与Z2+离子间形成的是配位键,在图
上标出配位键的电子给予的方向。
该结构中,Y原子与氢原子除了形成共价键外,
还可存在_______ ;
该结构中,碳原子的杂化轨道类型有_____;Y原子的杂化轨道类型为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com