
【题目】某纯天然食用香料X是一种从植物中提取的芳香族化合物,由香料X合成有机物H的路线如图所示:

已知:①A的核磁共振氢谱显示有6组峰;②H为酯类物质,结构中除苯环外还含有一个六元环; ③G的产量是衡量一个国家石油化工发展水平的标志。
请回答下列问題:
(1)A的结构简式为______,检验A中非含氧官能团所用的试剂为______。
(2)②的反应类型为______。反应③的化学方程式为______
(3)F中所含官能团的名称为______,其同分异构体中,遇FeCl3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为______种,写出其中一种的结构简式:______。
(4)设计一条以G为起始原料合成乙二醛的路线,无机物任选,注明反应条件。示例如下:
![]() ___________
___________
【答案】 ![]() 溴水(或溴的CCl4溶液) 加成反应 CH3CH2OH
溴水(或溴的CCl4溶液) 加成反应 CH3CH2OH![]() CH2=CH2↑+H2O 羟基、羧基 2
CH2=CH2↑+H2O 羟基、羧基 2  或
或 H2C=CH2
H2C=CH2![]() BrH2CCH2Br
BrH2CCH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() OHCCHO
OHCCHO
【解析】(1)由题意G的产量是衡量一个国家石油化工发展水平的标志,则G是乙烯;根据题给流程图,反应③为B转化为G的消去反应,则B为乙醇;反应①X转化为A和B的反应为酯的水解反应,则A分子中含羧基;反应②A转化为D的反应是加成反应,则A分子中含一个碳碳双键,结合分子式为C9H8O2及A的核磁共振氢谱显示有6个峰,含6种不同的氢原子,则A的结构简式为![]() ;检验A中非含氧官能团碳碳双键所用的试剂为溴水(或溴的CCl4溶液),观察溶液是否褪色,故答案为:
;检验A中非含氧官能团碳碳双键所用的试剂为溴水(或溴的CCl4溶液),观察溶液是否褪色,故答案为:![]() ;溴水(或溴的CCl4溶液);
;溴水(或溴的CCl4溶液);
(2)由上述分析知,反应②是加成反应,反应③是乙醇的消去反应,化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O,故答案为:加成反应;CH3CH2OH
CH2=CH2↑+H2O,故答案为:加成反应;CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(3)H为酯类物质,结构中除苯环外还含有一个六元环,是两个F分子发生酯化反应,F中所含官能团的名称为羟基、羧基;F分子有9个碳原子,其同分异构体中,遇FeCl3溶液发生显色反应,含酚羟基,能与碳酸氢钠溶液反应,含羧基,其苯环上一氯代物只有一种,符合条件的同分异构体有: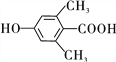 和
和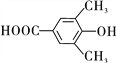 2种,故答案为:2;
2种,故答案为:2; 或
或 ;
;
(4)以G(乙烯)为起始原料合成乙二醛,依据逆推法设计合成路线为乙烯与溴发生加成反应生成1,2二溴乙烷,1,2二溴乙烷与氢氧化钠溶液发生取代反应得到乙二醇,乙二醇发生催化氧化反应生成乙二醛,合成路线示意图为H2C=CH2![]() BrH2CCH2Br
BrH2CCH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() OHCCHO,故答案为:H2C=CH2
OHCCHO,故答案为:H2C=CH2![]() BrH2CCH2Br
BrH2CCH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() OHCCHO。
OHCCHO。


科目:高中化学 来源: 题型:
【题目】某矿物甲由常见的三种元素组成,有如下变化。请回答下列问题:

(1)甲的化学式为_________。
(2)写出矿物甲与过量稀H2SO4/O2反应的离子方程式__________________。
(3)用文字叙述检验纯净的盐中的阳离子(写出实验操作、现象及结论)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知中和热的数值是57.3 kJ·mol–1。下列物质反应时,产生57.3 kJ热量的是( )
A.稀HCl和稀NaOH
B.1.0 mol·L-1 HCl和1.0 mol·L –1 NaOH
C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH
D.500 mL 2.0 mol·L-1 H2SO4和500 mL 2.0 mol·L-1 Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关高分子材料的叙述正确的是
A. 合金属于高分子材料 B. 光导纤维属于高分子化合物
C. 塑料为天然高分子化合物 D. 橡胶分为天然橡胶与人工合成橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0 L密闭容器中加入0.60 mol X(g),发生反应X(g)![]() Y(s)+2Z(g) ΔH>0,测得反应物X浓度与反应时间的数据如下表:
Y(s)+2Z(g) ΔH>0,测得反应物X浓度与反应时间的数据如下表:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.037 5 |
(1)3 min时用Z表示的平均反应速率v(Z)=________________________。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是______________。
由此规律推出反应在6 min时反应物的浓度a为__________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )

A. Na2O2中阴阳离子数目之比为1∶1
B. 反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
D. 反应③转移电子的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NH4HSO4溶液中滴加NaOH溶液,刚开始时反应的离子方程式是
A. H++OH-=H2O B. NH4++OH-=NH3·H2O
C. HSO4-+OH-=SO42-+H2O D. NH4++H++2OH-=NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关13153I的叙述中错误的是( )
A. 13153I的化学性质与12753I相同
B. 13153I的原子序数为53
C. 13153I的原子核外电子数为78
D. 13153I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH===2NaNO2+H2O。工艺流程如下

(1)分解塔中填有大量的瓷环,其目的是:_____________________________。
(2)按一定计量比在反应塔中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则分解塔中发生反应的化学方程式为: ____________________________。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是_____________________________________,若硝酸浓度过高,吸收塔中可能发生的副反应化学方程式为_____________________________________________。
(3)通入一定量的N2的目的是: ___________________________________。
(4)吸收塔中尾气如何再利用:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com